|
|||||||||||||||||||||||||||||||||||||||||||||
عند الدرجة 273 ْ س ولخصت نتائج الاختبارات في الجدول التالي :
من نتائج هذه الاختبارات حدد : أ. قانون سرعة التفاعل .
ب. ثابت السرعة . الحل : لاحظ الاختبارات 1 ، 2 ، 3 إن تركيز NO لم يتغير فيها ولكن تركيز Br2 تغير ، فعندما تضاعف التركيز من 0.1 إلى 0.2 تضاعف السرعة من 12 ـ 24 وعندما تضاعف التركيز 3 مرات تضاعف السرعة 3 مرات أيضاً من 12 ـ 36 . وهذا معناه أن سرعة التفاعل تتناسب طردياً مع 1[Br2]. وإذا أخذنا الاختبارات 1 ، 4 ، 5 التي ثبتنا فيها تركيز Br2 وغيرنا تركيز NO ، فإننا نجد أنه عندما تضاعف تركيز NO مرتين من 0.1 ـ 0.2 تضاعف السرعة 4 مرات ( 12 × 4 = 48 ) ، وعندما تضاعف تركيز NO ثلاث مرات تضاعف السرعة 9 مرات ( 12 × 9 = 108 ) . نستنتج من هذا أن سرعة التفاعل تتناسب طردياً مع 2[NO] . إذن قانون سرعة التفاعل بناءً على هذه التجارب العملية هو :
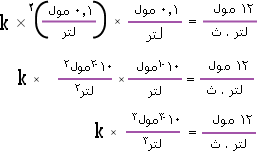
ب. لحساب ثابت سرعة التفاعل نأخذ أحد الاختبارات ونطبق :
وبالضرب التبادلي k × لتر . ث × 10-3 مول3 =12 مول × لتر3
تدريب : احسب السرعة عند الدرجة 273 ْ م (س) وذلك عندما نمزج Br2 ، NO بتركيز 0.4 ، 0.5 مول على الترتيب ...................... الجواب ( 960 مول / لتر . ث ) . 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14
|
|||||||||||||||||||||||||||||||||||||||||||||
|
Copyright © 2001 - 2010 SchoolArabia. All rights reserved الحقوق القانونية وحقوق الملكية الفكرية محفوظة للمدرسة العربية |
|||||||||||||||||||||||||||||||||||||||||||||