الرقم الهيدروجيني PH
اقترح العالم سورنس
الرقم الهيدروجيني لتفادي الصعوبة في التعبير عن [H3O+]
بأرقام صغيرة تشمل أسساً سالبة في المحاليل المختلفة.
تعريف الرقم الهيدروجيني
PH:
سالب
لوغاريتم ( للأساس 10 ) تركيز
أيون الهيدرونيوم PH
=- لو [ H3O+]
وكما
تعلم فإن [H3O+i]
في الماء النقي يساوي
1×10-7 مول/
لتر وعليه فإن
PH = -
لو 1×10-7 =
7
إ ذاً: الماء النقي
¥
محلول متعادل
¥
PH
=
ه7
وبناء على ما سبق فإن الرقم الهيدروجيني
يعبّر عن درجة الحموضة لمحلول
ما أي يدل على
مقدار تركيز[ H3O+I ]
:
للمحاليل الحمضية تكون قيمة PH <
ه7
للمحاليل المتعادلة تكون قيمة PH <
ه7
للمحاليل القاعدية تكون قيمة PH <
ه7
والشكل التالي يبين الرقم
الهيدروجيني التقريبي لعدد من المواد المألوفة
:
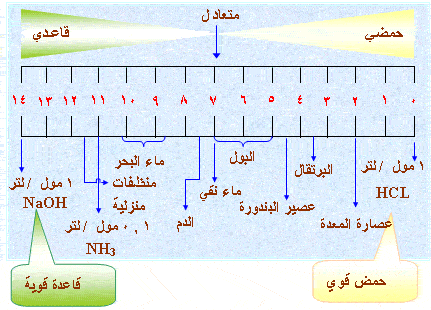
ملحوظة :
مدى الرقم الهيدروجيني يقع بين (صفر -
14)
والقيمتين ( صفر
،14)
لا تمثلان نهايتي مقياس PH وإنما
تبينان المدى الذي يتطلبه التعامل مع
أغلب
المحاليل المخففّة التي تستعمل في التجارب الكيمائية
.
