|
هو
الحمض الذي يتأين كلياً ( تأين تام )
في الماء .
أمثلة لأحماض قوية ( تحفظ )
حمض البيركلوريك
HClO4
حمض الهيدروكلوريك
HCl
حمض النيتريك
HNO3
حمض الكبريتيك
H2SO4
ويمكن التعبير عن التأين التام في الماء كما يلي :
( لا يوجد اتزان )
HClO4
+
H2O
¦
H3O+ + ClO4-i
HCl
+
H2O
¦ H3O++ Cl-i
ملحوظة :
1- السهم في اتجاه واحد ( غير معكوس )
2- يكون [
+H3O ] =
الحمض
سؤال :
إذا علمت أن تركيز حمض HNO3
( ه
1 × 10-2 مول / لتر )
جواب :
1- نكتب معادلة التأين للحمض HNO3
HNO3
+
H2O
¦
H3O++
NO3-i
2- يكون [HNO3 ] = [ <
/FONT
>
H3O+i
]
=
ه
1 × 10-2 مول / لتر
3- دائماً يهمل تركيز
[
+H3O ]
من الماء لأنه ضئيل جداً مقارنة بـ
[ +H3O ]
من الحمض
4- لحساب [ -OH
]
ه1×
10-14 =
[ -OH ]ه(1
× 10-2)

=
1 × 10-12 مول / لتر
سؤال مهم
:
إذا علمت أن تركيز
H2SO4
=
1
× 10-2 مول / لتر ، احسب
[
-H3O+ ] [ OH ]
|
وهو
القاعدة التي تتأين كلياً ( تأيناً تاماً ) في الماء
أمثلة لقواعد قوية ( تحفظ )
هيدروكسيد الصوديوم
NaOH
هيدروكسيد
البوتاسيوم
KOH
هيدروكسيد الكالسيوم
Ca(OH)2
هيدروكسيد الباريوم
Ba(OH)2
ويمكن
التعبير عن التأين التام لها في الماء كما يلي :
NaOH
¦
Na+
+ OH-i
KOH
¦
K+
+OH-i
ملحوظة
:
1- السهم في اتجاه واحد ( غير معكوس ) ( لا يوجد اتزان
)
2- يكون [
-OH ]
= القاعدة
سؤال :
إذا علمت أن تركيز
KOH
(
ه1
× 10-5 مول / لتر ) ، احسب
[
-H3O+
]
[ OH ]
جواب :
1- نكتب معادلة تأين
KOH
في الماء
KOH
¦
K+
+ OH-i
2-
يكون [
KOH
] = [ OH-i
]
= ه
1 × 10-5
مول / لتر
3- لحساب
[ H3O+i
]
1 × 10-14 = ( 1 × 10-5
) ه[
H3O+i
]
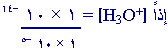
= 1 × 10-9
مول / لتر
احسب [ -OH
]
جواب :
1- نكتب معادلة تأين
Ba(OH)2
Ba(OH)2
"
Ba+2
+ 2OH-i
2-
يكون [
-OH ]
=
ه2
×
Ba(OH)2
=
2 × ( 0.5 × 10-2 )
= 1 × 10-2 مول / لتر
|
