يحترق الغاز المنزلي ويعطينا الطاقة ،
ومع ذلك لا يشتعل إلا إذا أعطي
شرارة لبدء التفاعل ، ولا يحترق
الهيدروجين في الهواء إلا إذا سخن قليلا
أو أعطي شرارة ، إن
هذين التفاعلين وغيرهما الكثير تحتاج إلى طاقة
خارجية حتى
يبدأ ، تعرف الطاقة الأقل الواجب إعطاؤها لتفاعل ما حتى
يبدأ باسم طاقة التنشيط .
إذا كانت طاقة التنشيط لتفاعل ما منخفضة كان التفاعل سريعاً
والعكس بالعكس .
من المعروف أن ارتفاع درجة الحرارة يؤدي إلى
زيادة طاقة حركة
الجزيئات وعند رفعها إلى حد معين يزداد عدد
الجزيئات التي تمتلك طاقة
تنشيط مما يجعل التفاعل يبدأ .
أي
التفاعلات الآتية سريعة وأيها بطيئة ؟ اذكر السبب .
أ-AgNO3(aq)
+ NaCl(aq) ¦ AgCl(s)
+ NaNO3(aq)i
هذا
التفاعل لحظي وسريع جداً ، السبب هو أن أيونات الفضة وأيونات
الفلور تنجذب مكونةً راسباً من كلوريد الفضة .
ب – Ba+2(aq)
+ SO-2eq ¦ BaSO4 (s)
تفاعل
آلي ولحظي .
جـ - 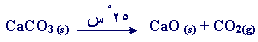
هذا التفاعل يحتاج إلى طاقة تنشيط عالية
والى درجات حرارة مرتفعة حتى
يبدأ ، كما أنه تفاعل ماص للطاقة . يبدأ
هذا التفاعل عند درجة حرارة قريبة من
1000 ْ .
د – 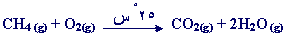
هذا التفاعل سريع ويحتاج إلى طاقة تنشيط
منخفضة ، يكفي شرارة
صغيرة
لبدئه ، ولكنه عند الدرجة 25 ْس بطيء وهذا من حظ
الإنسان ،
فلو كان هذا التفاعل سريعاً لانتشرت الحرائق بسبب
تسرب الغاز من
هنا وهناك .
