إذا درسنا سرعة
تفاعل كيميائي تحت درجة حرارة ثابتة فمن المؤكد في
هذه
الحالة أن السرعة ستعتمد على التركيز . لا بد أن تركيز المواد
المتفاعلة يلعب دورا رئيسا في سرعة التفاعل فتزداد بزيادته
مع بقاء
درجة الحرارة ثابتة .
العلاقة بين سرعة
التفاعل ودرجة الحرارة
من المشاهد
المألوفة لك والخبرات الحياتية أن سرعة التفاعلات
الكيميائية تزداد بارتفاع درجة الحرارة ، فمثلاً تعفن وتحمض الخضراوات
والفواكه أسرع في الصيف منه في الشتاء ، ونحن نحفظ الأطعمة
في
الثلاجة حيث درجة الحرارة المنخفضة تبطئ سرعة تلفها
.
يعتمد ثابت سرعة أي تفاعل على درجة
الحرارة . والثابت يزداد في
قيمته كلما ارتفعت درجة الحرارة . ولذلك فالثابت في معادلة السرعة
يخص درجة حرارة معينة ، لذلك حينما نقول
مثلا إن k(عند 200 ْس)
لتفاعل
ما يساوي
5.2×10-7 فهذا يعني أن هذا
الثابت يخص هذه الدرجة ، وإذا ارتفعت
(250
ْس) مثلا أو انخفضت (75
ْس) فإن قيمة الثابت تتغير تبعا لها .
التفاعل التالي:
I2 NO (g) +
Cl2(g) ¦ 2NOCl(g)I
وقانون السرعة
له R =
k [
NO ] [Cl2]
|
[NO]
مول /
لتر |
[Cl2]
مول /
لتر |
درجة الحرارة سْ |
سرعة التفاعل
مول / لتر .
ث |
|
10-2 |
10-2 |
25 |
4.9 ×
10-6 |
|
10-2 |
10-2 |
35 |
1.5 ×
10-5 |
|
10-2 |
10-2 |
45 |
4.8 ×
10-5 |
استخدم البيانات في الجدول لحساب k عند كل درجة حرارة وقارن بينهما
.
R عند (25
) =
K عند (25) × [NO2 ]
[Cl2
]
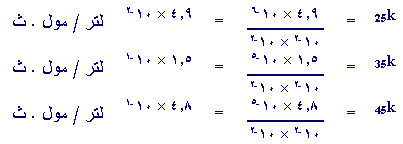
فإذا أجريت مقارنة بين
قيم k عند كل درجة لوجدت إن
:
K عند (25)
: K عند
(35) :
K عند
(45) =
4.9 × 10-2 : 1.5 ×
10-1 : 4.8 ×
10-1
= 1 : 2 :
3
تقريباً
لاحظ كيف أن
رفع درجة الحرارة بمقدار صغير يرفع قيمة الثابت عدة مرات
.
