قانون سرعة التفاعل ورتبة التفاعل
إن موضوع السرعة الكيميائية
هو من الموضوعات الشائكة في الكيمياء ، فلا يوجد علاقة
عامة واحدة أو حتى مجموعة علاقات يمكن بواسطتها حساب سرع
التفاعلات المختلفة . تكتشف قوانين سرع التفاعلات الكيميائية
المختلفة تجريبياً ، وهذا إجراء طبيعي في مجموعة العلوم الطبيعية
فهي علوم قائمة على التجربة .
لنفرض التفاعل
A(g) + 2B(g) ¦ 3C(g)
+ D (g)i
من الدراسة التجريبية جمعنا البيانات التالية للاختبارات
:
|
رقم الاختبار
|
[ A ]
مول / لتر
|
[ B ]
مول / لتر
|
سرعة استهلاك A مول / لتر . ث
|
|
1
|
10-2
|
10-2
|
1.5 × 10-3
|
|
2
|
10-2
|
2 × 10-2
|
3 × 10-3
|
|
3
|
10-2
|
3 × 10-2
|
4.5 × 10-3
|
|
4
|
2 × 10-2
|
10-2
|
6 × 10-3
|
|
5
|
3 × 10-2
|
10-2
|
3.5 × 10-3
|
لاحظ
الاختبارات 1 ، 2 ، 3 إن تركيز A
فيها ثابت ، بينما تضاعف تركيز B مرتين في الاختبار الثاني وثلاث مرات في الاختبار 3
. لاحظ السرعة لقد تضاعفت مرتين في الاختبار الثاني ، وثلاث
مرات في الاختبار الثالث ، إن هذا يدل على أن سرعة التفاعل تتناسب
مع تركيزB .
لاحظ
الاختبارات 1 ، 4 ، 5 إن تركيز B فيها ثابت ، بينما تضاعف تركيز A ، وعند مضاعفة التركيز في الاختبار4 زادت السرعة أربع مرات ، وفي الاختبار5 تضاعف
تركيز A ثلاث مرات وزادت السرعة تسع مرات ،إن هذا معناه
أن السرعة تتناسب مع تركيز[A]2
.
يمكننا الآن أن نكتب معادلة
السرعة لهذا التفاعل كما يلي :
سرعة
التفاعل (Rate) = ثابت × [A]2 × [B]
رتبة
التفاعل
لنعد إلى البيانات في الجدول السابق.
(سرعة التفاعل)1 = k (ثابت) × س[A] × ص[B]
(سرعة التفاعل) 2 = k × س[A] × ص[B]
حيث س ، ص تمثل القوة التي يجب رفع التركيز إليها .
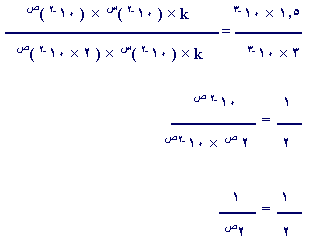
إذن 2 = 2 ص
إذن ص = 1 ، أي أن تركيز
B في معادلة
السرعة يجب أن يرفع للقوة ( 1)
والآن
لنأخذ
(سرعة
التفاعل)1 = k × س[A]
× ص[B]
(سرعة
التفاعل)5 = k × س[A] × ص[B]

إذن معادلة سرعة التفاعل هي :
تشير رتبة
التفاعل إلى القوة التي يجب أن يرفع إليها التركيز عند كتابة
معادلة السرعة . وعلى ذلك ففي حالة تفاعلنا هذه يدخل تركيز
A
معادلة السرعة
مرفوعا للقوة (2) . أي أن التفاعل من المرتبة
الثانية بالنسبة للمادة A ،
وبنفس المحاكة التفاعل هو من المرتبة الأولى بالنسبة للمادة
B ، أما قانون
سرعة التفاعل فهو من المرتبة الثالثة
أي مجموع 2+1 .
لاحظ أن مرتبة التفاعل لا تعتمد على معاملات
المواد في المعادلة
الموزونة
، فمعامل A في المعادلة الموزونة كان (1) ، ومعاملB
كان (2) ،
ومع ذلك
فرتبة التفاعل بالنسبة
لـِ A كانت الثانية ، وبالنسبة لـِ B كانت الأولى .
