|
سرعة التفاعل
الكيميائي وآلية التفاعل
سرعة التفاعل والعوامل المؤثرة
فيه
(3)
|
|
السرعة
اللحظية للتفاعل
وهي سرعة التفاعل في لحظة ما ، مثلاً
في حالة التفاعل ، المطلوب تحديد سرعة التفاعل عند الثانية 35
. لحساب سرعة التفاعل عند
هذه الثانية نرسم الخط البياني لتركيز CO مقابل الزمن ، ثم نرسم مماسا للخط
البياني الناتج عند الثانية 35
، إن ميل المماس يساوي السرعة عند تلك
الثانية
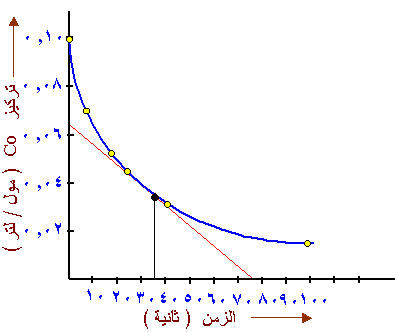
سؤال1 :
احسب سرعة التفاعل
(اعتماد على الرسم البياني)
عند : أ-
الثانية العاشرة .
ب- الثانية الأربعين
.
العلاقة بين عدد
مولات المواد الناتجة والمتفاعلة :
التفاعل CO(g) + NO2(g) ® CO2(g) + NO(g)
المعادلة موزونة ، ولذلك فإنه كلما
تفاعل مول من CO
ينتج مول من CO2 وكلما نتج مول من NO ينتج مول من CO2 ويستهلك مول من NO2 وآخر من CO .
ولكن
لو درسنا التفاعل N2(g)+ 3H2(g) ®
2NH3(g)
إن
عدد المولات في هذا التفاعل غير متساو ، إن ملخص المعادلة هو
التالي : يتفاعل مول واحد من N2 مع ثلاث مولات من H2 وينتج من ذلك مولان من
غاز
الأمونيا .
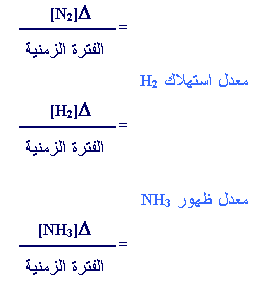
في هذه الحالة إن
معدل سرعة استهلاك
N2


سؤال2
:
في
التفاعل الآتي :
C2H4(g) + 3O2(g) ® 2CO2(g) +
2H2O(g)
إذا
كان معدل سرعة استهلاك O2 =
0.45 مول / لتر . ث المطلوب
:
أ-
معدل سرعة استهلاك C2H4 .
ب-
معدل سرعة إنتاج CO2 .
جـ-
معدل سرعة إنتاج H2O .
لمعرفة الاجابات
اضغط هنا
|
