|
التفاعلات بين الحموض
والقواعد
المعايرة
الدرس السادس |
|
ملحوظة هامة :
1 ـ
أن قيمة
PH
تتغير ببطء إلى أن وصل حجم القاعدة المضافة إلى (25
مل) وعندها
حدث تغيّر مفاجىء في قيمة PH
. لأننا حقيقةً وصلنا إلى نقطة التكافؤ حيث:
عدد مولات
OH-
المضافة
=
عدد مولات
H3O+
2 ـ
أصبح المحلول متعادلاً (PH
ه=
ه7)
لأن الملح المتكوّن
NaCl
لا يتميّه.
* ومن المثال السابق نستطيع أن نضع الجدول التالي:
|
|
أ |
ب |
جـ |
د |
هـ |
|
حجمNaOH
المضاف (مل) |
صفر |
10 |
24.5 |
25 |
25.05 |
|
قيمة PH |
1 |
1.37 |
3 |
7 |
11 |
وعليه فإنه يمكن رسم العلاقة بين قيمة PH وحجم
القاعدة المضافة فنحصل على
منحنى يعرف بمنحنى المعايرة.
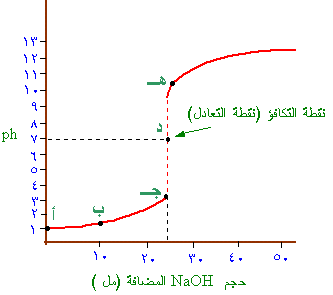
منحنى المعايرة لمحلول
0.1
مول/لتر
HCl
مع محلول
0.1
مول/لتر
NaOH
وبناء على ما سبق وعند التدقيق في جدول الكواشف المجاور نلاحظ
ما يلي:
|
الكاشف |
تغير اللون |
مدى الرقم الهيدروجيني الذي يحدث فيه تغير اللون |
|
الميثيل البرتقالي |
أحمر
– أصفر |
3.2 – 4.4 |
|
عباد الشمس |
أحمر
ـ أزرق |
5 – 7 |
|
الفينولفثالين |
عديم
– زهري |
8.2 - 10 |
1 ـ
قبل الوصول إلى نقطة التكافؤ (التعادل) – عند النقطة
(جـ).
كانت قيمـة
PHه
=
ه3
¬
المحلول لا يزال حمضي ، نجـد أن ألوان
الكواشف في
حالة استخدام أي منها تكون
كما يلي:
ميثيل برتقالي
: أحمر
عباد الشمس
: أحمر
فينولفثالين
: عديم
2 ـ
عند نقطة التكافؤ (التعادل) – عند نقطة (د).
أي عند إضافة (0.5
مل) أخرى من NaOH
(حجم
NaOH
كلي =
25
مل) قفزت
قيمة
PH
من
3
¬
ه
7 .
بالرغم أن الكمية المضافة (
0.5
مل NaOH
)
هي عبـارة عن بضع قطرات. وبناء
على ذلك نجد أن
الميثيل
البرتقالي سوف
يعطي اللون الأصفر, (والذي يظهر حتى
قبل الوصول لنقطة التكافؤ) وعباد الشمس سوف يعطي
اللون الأزرق (والذي يظهر
عند الوصول لنقطة التكافؤ)أما الفينولفثالين سوف
يبقى عديم اللون.
3 ـ عند النقطة هـ
عند
إضافة (0.5
مل)
أخرى
NaOH
(حجم
NaOH
كلي =
25.5
مل) نجد أن قيمة
PH
قفزت من
7
¬
ه11،
بالرغم أن الكمية المضافة (
0.5
مل NaOH
)
هي عبـارة عن بضع قطرات. وبناء على ذلك نجد أن الميثيل
البرتقالي يبقى اللون
أصفر
وعباد الشمس يبقى على اللون
الأزرق. أما الفينولفثالين والذي
يغيـر لونه
عـند (
8.2)
(وسط قاعدي) فإن اللون
الزهري يظهر عند
PH
ه=
ه10 وهذا يشير إلى
أن تغيّر لون الكاشف حصل
بعد نقطة التكافؤ
(تعادل).
لذلك نقول :
1 ـ
عند معايرة حمض قوي وقاعدة قوية فإن نقطة
التكافؤ (التعادل) تكون عند
PHه
=
ه7.
ويفترض أن يتغيّر
لون الكاشف عند تلك النقطة. إلاّ أنه وفي معظم الحالات يتغيّر
اللون
بعد نقطة التكافؤ أو قبلها.
2 ـ
عند معايرة حمض قوي وقاعدة قوية فإن PH
للمحلول حول نقطة التكافؤ تتغير
فجأة من (4 – 11) وفي هذا المدى تتغير ألوان الكواشف
السابقة جميعاً. لذلك
يمكن
استخدام أي منها كدليل لمعرفة نقطة التكافؤ
(تعادل).
|
