|
التفاعلات بين الحموض
والقواعد
المعايرة
الدرس السابع |
|
سؤال :
احسب
قيمة PH
للمحلول الناتج من مزج (20
مل)
من حمض
HCl
تركـيزه (0.1
مول/لتر) مع (30
مل) من
KOH
تركيزه (0.2
مول/لتر). ثم حدد نوع المحلول الناتج (حمضي ـ قلوي ـ متعادل).
جواب :
(12.9)
سؤال :
احسب
قيمة PH
للمحلول الناتج من إضـافة (10
مل)
من
H2SO4
تركيـزه (0.3
مول/لتر) إلى (50 مل) من محلول
NaOH
تركيـزه (0.01
مول/لتر). ثم حدد نوع المحلول الناتج (حمضي ـ قلوي ـ متعادل).
سؤال :
إذا
علمت أن (15
مل)
من محلول
H2SO4
تركيزه (0.5
مول/لتر). احسب تركيز NaOH
اللازم لكي يتعادل تماماً مع الحمض. علماً بأن حجم
NaOHه
=
ه30 مل.
جواب :
عند التعادل التام يكون جميع -OH
(القاعدة) تفاعل تماماً مع جميع
H3O+
(الحمض).
عدد
مولات
+
H3Oه
=
ح
× ت ×
2
ï
لأن
H2SO4
ثنائـي البروتـون
H2SO4 +
H2O
"
2H3O+ +
SO-24
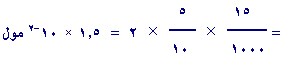
وحيث
أنه عند التعادل التام يجب أن يكون
عدد
مولات H3O+
=
عدد مولات
OH-
،
وحيث
أن عدد مولات
H3O+ه
=
ه1.5 × 10-2
مول، إذاً يجب أن يكون عدد مولات
OH-
ه=
ه1.5 × 10-2
مول
وعليه: عدد مولات
OH-ه
=ه
1.5 × 10-2 مول
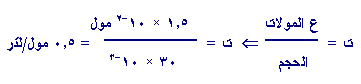
سؤال :
احسب
تركيز حمض
HCN
، إذا علمت أن (20
مل) من هذا المحلول تتفاعل تماماً مع
(10
مل)
NaOH
تركيزه (0.3
مول/لتر)
جواب :
(0.15 مول / لتر)
سؤال :
ما
حجم محلول
HCl
تركيز (0.02
مول/لتر) الذي يلزم لتتفاعل مع (100
مل) من محلول
NaOH
تركيزه (0.1
مول/لتر).
جواب :
(0.5
لتر) |
