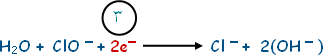|
||||||||||||||||||||||||||||||||||
خطوات موازنة التفاعلات في الوسط القاعدي بطريقة
نصف التفاعل : بما أن الوسط قاعدي إذن يظهر فيه المواد والأيونات المعطاة أصلاً يضاف إليها أيونات الهيدرو كسيد (OH-i) وجزيئات الماء. تبقى الأمور الأساسية التي أشرنا إليها عند الموازنة في الوسط الحمضي كما هي دون تغيير.
يوجد أكثر من طريقة لموازنة معادلات التأكسد والاختزال في الوسط القاعدي، وهذا أمر طبيعي متفق مع القاعدة العلمية المعروفة والتي نصها: "يوجد هنالك دائماً أكثر من طريقة صحيحة لحل المشكلة أو المسألة موضوع البحث". مسألتنا هنا واضحة ومحددة وهي الإجابة عن السؤال التالي: كيف نزن معادلة تأكسد واختزال في الوسط القاعدي بطريقة نصف التفاعل؟
الطريقة الأولى: سنوضح خطوات هذه الطريقة من خلال المثال التالي:
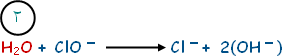
1. الخطوة الأولى: نقسم المعادلة إلى نصفين:
2. الخطوة الثانية: نأخذ كل نصف لوحده ونزنه باستخدام الماء وأيونات الهيدروكسيد (أيونات الهيدروكسيد هي مميز الوسط القاعدي).
نلاحظ أن ذرات الكروم متزنة إذن علينا أن نزن ذرات الأوكسجين وهي غير متزنة. يتم ذلك بإضافة عدد من أيونات (OH-i) إلى الجهة التي فيها العدد الأقل من ذرات الأوكسجين بحيث يكون عدد أيونات الهيدروكسيد يساوي مثلي النقص في عدد ذرات الأوكسجين.
لاحظ أن النقص في عدد ذرات الأوكسجين هو ذرتان وأننا أضفنا مثلي ذلك العدد من أيونات الهيدروكسيد. لإكمال الموزانة نضيف إلى الطرف الأيمن عدداًمن جزيئات الماء يساوي النقص في عدد ذرات الأوكسجين.
لاحظ الآن أن نصف تفاعل التأكسد قد اتزن من حيث عدد الذرات، تأكد من ذلك بنفسك، بعدَ الذرات من كل نوع في كل من طرفي المعادلة تجدها متساوية. نكمل الموازنة بجعل مجموع الشحنة في طرفي المعادلة ويتم ذلك بإضافة عدد من الإلكترونات لأحد طرفيها. نلاحظ أن مجموع الشحنة في الطرف الأيسر = ـ 5. وأن مجموع الشحنة في الطرف الأيمن = ـ 2. إذن نضيف ثلاث إلكترونات 3e-i إلى الطرف الأيمن. وبناءً على ما تم إنجازه تكون معادلة نصف تفاعل التأكسد عد اتزانه اتزاناً على الشكل التالي:
3. الخطوة الثالثة: نقوم بعملية مشابهة للخطوة السابقة على نصف تفاعل الاختزال.
4. الخطوة الرابعة: الآن علينا أن نجمع نصفي التفاعل للحصول على التفاعل الكامل، ولكن علينا قبل ذلك مساواة عدد إلكترونات نصف تفاعل التأكسد بعدد إلكترونات نصف تفاعل الاختزال لأن عدد الإلكترونات المفقودة يجب أن يساوي عدد الإلكترونات المكتسبة.
لجعل الإلكترونات متساوية في نصفي التفاعل نضرب نصف تفاعل التأكسد في العدد ( 2 ) ونصف تفاعل الاختزال في العدد ( 3 ) فتكون النتيجة:
وبعد الجمع واختصار جزيئات الماء والهيدروكسيد من كلا الطرفين نصل إلى المعادلة الموزونة وهي:
تأكد من صحة الموازنة بمراجعة عدد الذرات من كل نوع في طرفي المعادلة وبأن مجموع الشحنة في الطرف الأيسر هو نفسه مجموعها في الطرف الأيمن.
|
||||||||||||||||||||||||||||||||||
|
Copyright © 2001 - 2013 SchoolArabia. All rights reserved الحقوق القانونية و حقوق الملكية الفكرية محفوظة للمدرسة العربية |
||||||||||||||||||||||||||||||||||