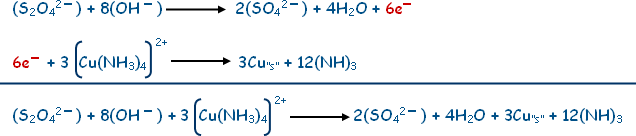|
|||||||||||||||||||||||||||||||||||||||||
خطوات موازنة التفاعلات في الوسط القاعدي بطريقة
نصف التفاعل : الطريقة الثانية: وفيها نبدأ بخطوات موازنة المعادلة وكأنها في وسط حامض وبعد الموازنة نضيف أيونات الهيدروكسيد بمقدار عدد أيونات
نحن لا نفضل استخدام هذه الطريقة لأن الوسط القاعدي تسيطر فيه أيونات الهيدروكسيد ولا داعي لظهور أيونات الهيدروجين المميزة للوسط الحامضي.
مثال : زن المعادلة التالية التي تتم في وسط قاعدي.
باختصار عدد جزيئات الماء بين الطرفين.
6. الخطوة السادسة: نساوي عدد الإلكترونات في نصفي التفاعل لذلك نضرب نصفي تفاعل الاختزال في العدد ( 3 ).
7. الخطوة السابعة: نجمع نصفي التفاعل المتزنين:
تأكد من صحة الموازنة عد ذرات كل عنصر في كل طرف وتأكد أيضاً من تساوي الشحنة في كلا طرفي المعادلة.
|
|||||||||||||||||||||||||||||||||||||||||
|
Copyright © 2001 - 2013 SchoolArabia. All rights reserved الحقوق القانونية و حقوق الملكية الفكرية محفوظة للمدرسة العربية |
|||||||||||||||||||||||||||||||||||||||||