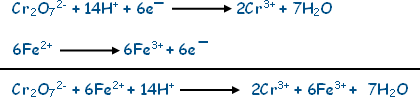|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
خطوات موازنة التفاعلات في الوسط الحمضي بطريقة نصف التفاعل Ion - Electron Partial Method for balancing Redox Equations:
الحل :
هنا متزنة حيث يوجد ذرة حديد واحدة في الطرف الأيسر ومتلها في الطرف الأيمن. بقي أن نوازن الشحنة ويتم ذلك بإضافة الكترون واحد إلى الطرف
1. هنا يوجد ذرات من الأوكسجين، ولكن قبل العمل على موازنتها علينا أولاً موازنة ذرات الكروم ونلاحظ أن عددها في الطرف الأيسر ذرتان بينما في الطرف الأيمن ذرة واحدة لذلك تكون خطوة الموازنة الأولى:
2. لموازنة الوكسجين نضيف سبع جزيئات ماء إلى الطرف الأيمن من المعادلة لأن ب نقصاً في عدد ذرات الأوكسجين مقداره سبع ذرات عما هو في الطرف الأيسر.
3. نزن ذرات الهيدروجين بإضافة عدد من أيونات الهيدروجين إلى الطرف الذي به نقص في هذت العدد وهو هنا الطرف الأيسر.
وبناءً على ما سبق، نضرب نصف تفاعل الاختزال في (1) ونصف تفاعل التأكسد في (6).
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Copyright © 2001 - 2013 SchoolArabia. All rights reserved الحقوق القانونية و حقوق الملكية الفكرية محفوظة للمدرسة العربية |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||