|
1-الغازالمثالي: هو غاز افتراضي
لا يمكن تسييله وذلك لانه لا يوجد قوى
........بين جزيئاته.
2-أيهما اقرب إلى سلوك الغاز
المثالي غاز
CH4
أم غازHCl؟
فسر
معادلة
الحالة للغازات: لنعد قليلاً إلى قوانين الغازات
إلى إثبات. لنعط عدد المولات الرمز ع. إذن
حaع
4- فإذا جمعنا
العلاقات الثلاث السابقة معاً حصلنا
ع
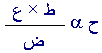

فان
ح ض = ط ع ر وهذه تعرف بمعادلة الحالة للغازات وهي تجمع بين
الحجم والضغط، ودرجة الحرارة، وعدد المولات، فإذا عرفنا قيم
ثلاثة منها أمكننا حساب قيمة الرابع بسهولة اعتماداً على هذه
المعادلة.
أما
قيمة الثابت (ر) فقد حسبت مخبرياً
ونتيجة التطبيق على اكثر من غاز، والمثال التالي يوضح
ذلك:
- في إحدى التجارب المخبرية تبين أن حجم مول
واحد من أحد الغازات 11.8 لتر، عند الدرجة صفر س وضغط
1.90
جوي. من هذه المعلومات احسب
قيمة الثابت (ر)الحل:
الحجم × الضغط =
عدد
المولات × درجة الحرارة المطلقة × ر
درجة الحرارة المطلقة = 0
+ 273
=173
ْk
11.8 لتر × 1.90 جوي = ا
مول ×273
ْ
k
× ر
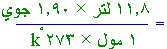
= 0.0821
لتر.جوي.مول-1
.ْk-1
سؤال: استخدم قيمة ر التي حسبتها في
السؤال السابق لحساب حجم المول الواحد من الغاز في الظروف
المعيارية.
-حدد المقصود بالظروف
المعيارية قبل ان تحل السؤال.
الإجابات
|