|
تفسير قوانين الغازات حسب نظرية الحركة
الجزيئية
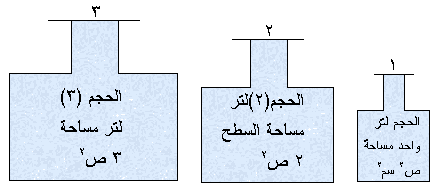
الأوعية الثلاثة أعلاه يحوي الواحد
منها 0.1
مول من غاز
N2 وعند نفس درجة الحرارة. اجب عما
يلي:
1-قارن بين الجزيئات في
الوعاء الأول والوعاء الثاني والوعاء
الثالث.
2-لو فرضنا أن عدد التصادمات بين جزيئات
الغاز وسطح الوعاء الأول = س صدمة في الثانية الواحدة، فكم يكون
عدد التصادمات في الثانية الواحدة في الوعاء
الثاني؟
3-ان عدد التصادمات التي يحدثها
الغاز على جدران الوعاء هي مقياس..........
4-اذن يكون ضغط
الغاز في الوعاء الأول مثلي ضغط الغاز في الوعاء .........5-ويكون ضغط الغاز في الوعاء الثالث ثلثي
ضغط الغاز في الوعاء
.............
6-يفسر ما ناقشناه
أعلاه قانون ..............الذي يربط بين حجم الغاز
المحصور
وضغطه.
7-لو فرضنا أننا سخنا الغاز في الوعاء
الثالث وهو مغلق فماذا يحدث للطاقة الحركية
للجزيئات؟
8-إن تسخين الغاز
والوعاء مغلق يعني أن
..................الغاز لم يتغير
.
9-نتيجة لزيادة الطاقة الحركية للجزيئات
يزداد عدد وقوة التصادمات مع جدران الوعاء وهذا يعني زيادة في
...............الغاز.
10-يفسر هذا المثال
قانون ...........الذي يربط بين درجة
حرارة الغاز وضغطه عند ثبات حجمه.
11-إذا رفعنا غطاء الوعاء الثاني وتركناه
مفتوحاً ليصبح الضغط داخله مماثلاً للضغط الخارجي، ثم سخناه بعد
ذلك قليلاً (وهو مفتوح)، فماذا يحدث
للغاز في الوعاء من حيث: أ.
ضغطه
ب. حجمه
ج. عدد
جزيئاته.
12-يفسر هذا المثال قانون ..............الذي يربط بين الحجم
ودرجة الحرارة تحت ضغط ثابت.
الإجابات
|
|