|
الاتزان في محاليل الحموض الضعيفة(2)
|
|
سؤال :
إذا كان لديك محلول
HCl تركيزه
(0.1) مول/لتر ومحلول حمض HF تركيز
(0.1 مول / لتر) أجب عما يأتي
:
1 - أيّهما
يكون [
H3O+I] فيه
أكبر (وضّح)
2 - أيّهما
تكون PH له
أكبر. (وضّح)
والجدول
التالي يوضح ثوابت التأين Ka
لعدد من الحموض الضعيفة:
جدول ثوابت التأين (Ka ) لعدد من الحموض الضعيفة (ليس
للحفظ)
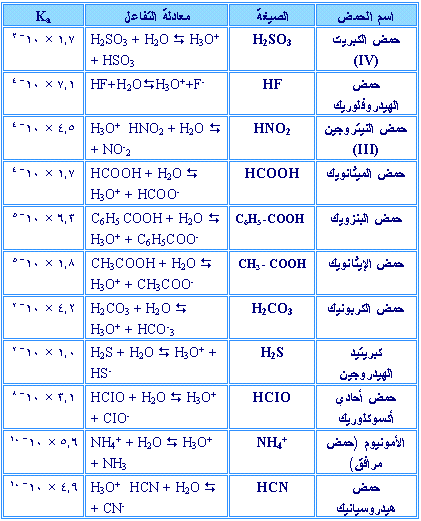
سؤال :
بالرجوع للجدول السابق أجب عما يأتي:
1 - اذكر اسم أقوى
الحموض المدرجة في الجدول.
2 - قارن [H3O+] في
محاليل متساوية التركيز من HNO2 ، HF ، HCl.
3 - يُعَد NH4+ حمضاً مفهوم برونستد – لوري. اكتب معادلة تبيّن سلوكه
الحمضي في
الماء ثم اكتب تعبير Ka له .
4 - هل تتوقع أن
تكون PH
لمحلول CH3COOH تركيزه
(0.1 مول/لتر)
أكثر أم أقل من 2 ؟ ولماذا ؟
|
|
