|
تميّه الأملاح
الدرس
الخامس
|
|
|
رابعاً: (إضافة الملح
الناتج من حمض ضعيف إلى
الماء)
مثال :
ماذا يحدث
لقيمة
PH عند إضافة
NH4CN إلى
الماء؟
كما تعلم 1- قيمة
PH للماء النقي تساوي
7.
2- عند إضافة الملح NH4CN إلى
الماء فإنه يتفكك كلياً كما يلي :
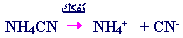
3- يتميّه كل من
–CN
و
NH4+ كما
يلي :
NH4+ + H2O D
H3O+ +
NH3
HCN
+
- OH
D
H2O
+
-CN
حيث أنه ينتج عن تميّه الأيونين
أيونات
H3O+
و-
OH فإذا
كان:
[H3O+] >
[-
OH] فإن المحلول حمضي
. ( PH
ا<
7)
[H3O+] =
[-
OH] فإن
المحلول متعادل
. ( PHا=
7)
[H3O+]
<
[- OH] فإن المحلول قاعدي
. (PH
ا>7)
ولكن كيف يتم تحديد
ذلك؟
إن هذا النوع من
الأملاح (المكوّن من حمض ضعيف وقاعدة ضعيفة) تكون صفة المحلول
وتأثيره على الكواشف متوقفة على قيمة كل من
Ka للحمض الضعيف
و Kb للقاعدة الضعيفة
كالتالي:
1- إذا كان
Ka للحمض = Kb للقاعدة، فإن المحلول متعادلاً حيث
PH
= ا 7
2-
إذا كان Ka للحمض > Kb للقاعدة، فإن المحلول حمضياً حيث
PH ا< 7
3 ـ إذا كان
Ka للحمض <Kb للقاعدة، فإن المحلول
قاعدياً حيث PH ا> 7
وبالنسبة للمثال
السابق NH4CN نجد أنKb
(-CN) > Ka
(NH4+)
وعليه فإن المحلول القاعدي (PHا > 7
)
و يمكن تلخيص ما سبق
كما يلي:
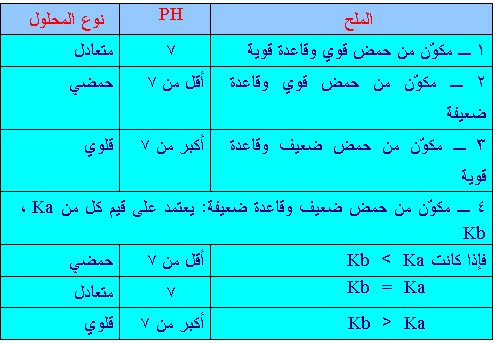
* أن صفات
الأملاح (حمضية , قلوية ,متعادلة ) تعتمد على قوة الحمض والقاعدة
اللذين تكون منهما الملح و لذلك فيمكن أن تقسم إلى أربعة أقسام
:
* تعريف التميّه :هو تفاعل أيونات الملح مع الماء
لتكوين OH-I
أو + H3O أو
كليهما
معاً.
|
|
