|
المحاليل المنظمة
الدرس السادس
|
|
ثانياً:
نحسب قيمة
PH
بعد إضافة 1مول من
NaOH
إلى لتر من المحلول المنظم. وهذا يعني:
1-
إضافة
0.1
مول/لتر من أيونات
OH- إلى المحلول المنظم. والتي سوف تتفاعل
مع
H3O+ الموجودة في المحلول المنظم وبالتالي سوف
يختل الاتزان فيتأين مزيداً
من الحمض
CH3COOH
1-
نقصان في تركيز
CH3COOH
بمقدار (0.1
مول/لتر) [كمية
NaOH
المضافة]
2-
نقصان في تركيز
- CH3COO بمقدار (0.1
مول/لتر) [كمية
NaOH
المضافة]
وعليه يصبح [CH3COOH] جديد =
0.2 - 0.1
=
0.1
مول/لتر
[-CH3COO] جديد
=
0.3 + 0.1
= 0.4 مول/لتر
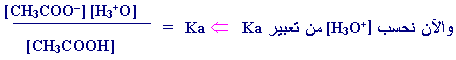
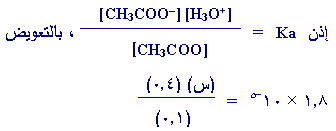
س
= ه [ H3O+i ]
ه =
4.5 ×
10-6
مول/لتر
إذاً
PH = - لو [H3O+] ه = ه -
لو 4.5 ×
10-6 =
5.3
مقدار التغير في قيمة
PH = ه
5.3 – ه 4.9 =
0.4 (لاحظ أن مقدار التغير طفيف)
سؤال :
محلول منظم مكوّن من
NH3
(ه 0.2 مول/لتر)
و
NH4Cl (ه
0.3 مول/لتر). احسب
قيمة
PH
لكل مما يلي :
1- لمحلول
المنظّم علماً بأن
Kb
NH3 =ه
1.8 ×
10-5
جواب : (PH
ه=
ه9.1)
2- بعد إضافة (0.1 مول) من NaOH إلى لتر من المحلول
السابق.
جواب : (PHه = ه9.4)
3- بعد إضافة (0.1 مول) من
HCl إلى لتر من المحلول
السابق.
جواب : (PH
ه=ه 8.7)
|
