|
المحاليل المنظمة
الدرس الثالث
|
|
والآن لا بد وأن نعرف عمل المحاليل المنظمة بصورة كميّة
(حسابياً).
مثال :
احسب قيمة
PH لكل مما يلي :
1-
محلول
منظم مكوّن من حمض الميثانويك
HCOOH
تركيز (0.5
مول/لتر) وميثانوات الصوديوم
HCOONa
تركيزه (0.7
مول/لتر). علماً بأن
Ka
HCOOH ه= ه1.7 ×
10-4
2- كم تصبح قيمة
PH
للمحلول السابق عند إضافة
0.1
مول من
HCl
إلى لتر واحد منه ؟
جواب :
1- لحساب قيمة
PH
للمحلول المنظم :
HCOOH +
H2O
D
H3O+ +HCOO -I
|
ه0.5 |
صفر |
صفر |
بداية التفاعل
|
|
س - |
س + |
س +
|
مقدار التغير
|
|
( ه0.5 -
س ) |
س |
س |
عند الاتزان
|
HCOONa
¦
Na+ + HCOO-I
|
ه0.7
|
صفر |
صفر |
بداية
التفاعل |
|
صفر |
ه0.7
|
ه0.7
|
مقدار التغير |
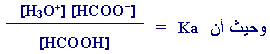
والآن نأخذ بعين الاعتبار :
ه0.5 + س = [HCOO
H]
8
تهمل لصغرها فيصبح
التركيز تقريباً
0.5 مول / لتر
[H3O+] = س ومصدره ما تفكك من الحمض.
[-HCOOH] =
ه 0.7 + س
8 تهمل لصغرها لأن مصدرها الحمض الضعيف فيصبح
التركيز تقريباً 0.7 مول / لتر
وبالتعويض في
Ka:
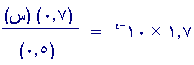
س = [ H3O+i] = ه
1.2 ×
10-4 مول
/ لتر
إذاً قيمة PH =
- لو [ H3O+i] ه= - لو 1.2 × 10-4 =
3.85
وهذه هي قيمة PH
للمحلول المنظم قبل إضافة الحمض HCl.
|
