|
|
المحاليل المنظمة
الدرس الرابع
|
|
2-
الآن
نحسب قيمة
PH
للمحلول المنظم بعد إضافة
0.1
مول من HCL
الى (1 لتر)
من المحلول
المنظّم.
إضافة
0.1
مول من
HCl إلى
1
لتر من المحلول
المنظم فهذا يعني :
أ- إضافة ما مقداره
0.1
مول/لتر من الحمض
HCl
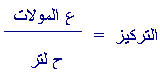
ب- إضافة ما مقداره
0.1
مول/لتر من
H3O+ إلى المحلول المنظم
.
جـ- الأيونات المضافة من
[H3O+I] سوف تتفاعل مع أيونات
–HCOO
للمحلول المنظم مما يؤدي إلى :
1- نقصان في تركيز
–HCOO
بمقدار (0.1 مول/لتر) [كمية
HCl
المضافة]
2- زيادة في تركيز
HCOOH
بمقدار (0.1 مول/لتر) [كمية
HCl
المضافة]
HCOO- +
H3O+
D
HCOOH + H2Oi
وعليه يصبح : [–HCOO]
الجديد = (0.7)-(0.1) = 0.6 مول/لتر.
HCOOH]
]الجديد
=
(0.5) +
(0.1) = ه
0.6 مول/لتر
والآن نحسب [H3O+]
:
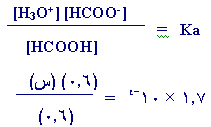
[H3O+]
= س = 1.7 ×10 -4مول/
لتر
وبالتالي
PH:
PH = - لو [H3O+] = - لو
1.7 × 10-4 = 3.85
(قارن بين قيمة PH للمحلول المنظم قبل وبعد إضافة الحمض. واحسب التغير في
PH)
|
