يعتبر
مفهوم برونستد ـ لوري لكل من الحمض والقاعدة أعم من تعريف أرهينيوس
لأنه نجح في تفسير الكثير من التفاعلات، إلاّ أنه لم يستطع تفسير
السلوك الحمضي أو القاعدي في بعض التفاعلات، كتفاعل الحمض (BF3)
مع القاعدة (NH3) والذي يتم بدون انتقال
بروتونات. لذلك جاء مفهوم لويس
ليكون أكثر شمولاً
للتفاعلات, وذلك اعتماداً على التركيب الإلكتروني للمركب.
تعريف الحمض : هي
كل مادة تستطيع أن تتقبل زوجاً (أو أكثر)
من الإلكترونات.
تعريف القاعدة : هي
كل مادة تستطيع أن تعطي زوجاً (أو أكثر)
من الإلكترونات.
استنتاج
: وفقاً لمفهوم لويس فإن تفاعل حمض ـ قاعدة
يشتمل على منح زوج
من الإلكترونات
من مادة لأخرى.
والآن دقق النظر في التفاعلات التالية
والتي تمثّل تفاعلات بين قواعد
وحموض برونستد ـ لوري.
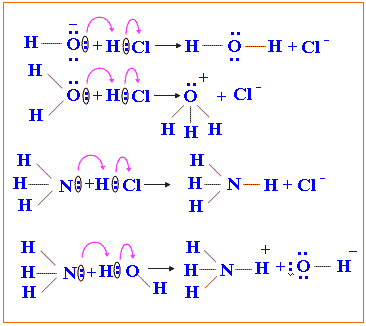
1 - حموض برونستد ـ
لوري هي أيضاً حموض لويس.
2- قواعد برونستد ـ لوري هي أيضاً
قواعد لويس.
ولتوضيح ذلك نقول في تفاعل الأمونيا
والماء أنه:
* وفقاً
لمفهوم برونستد ـ لوري: فإن الحمض (H2O) منح بروتوناً استقبلته القاعدة
(NH3).

|
