|
البنية الالكترونية للذرة
مزايا الأفلاك الهجينة
(5)
|
|
تهجين
sp2
:
لننظر الآن إلى ذرة الفلور فنجد أن
توزيعها الإلكتروني كما يلي :
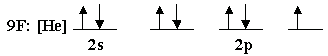
وتحوي
إلكترون واحد منفرد : تتقدم ثلاث ذرات من الفلور ويرتبط فلك
p, ذو الإلكترون المنفرد في كل واحده منها
برابطه سكما
( رابطة لها
نفس اتجاه المحور بين النواتين ) مع أحد أفلاك sp2 الثلاث وتقوم الذرتين الأخريين
بعمل مشابه , وينتج مركب BF3 ذو
الروابط الثلاث المتكافئة والتي تتجه نحو رؤوس مثلث مستوى متساوي
الأضلاع وزاوية الربط فيها 120 ْ (انظر الشكل ) . وهو الشكل الحقيقي
والواقعي لهذا الجزيء .
مثال (2)
: جزيء C2H4
هذا
الجزيء له شكل مثلث مستوي وزاوية الربط فيه 120 ْ , إذن لابد أن
تهجين من نوع
sp2 يحدث في ذرة الكربون :
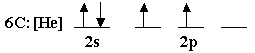
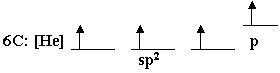
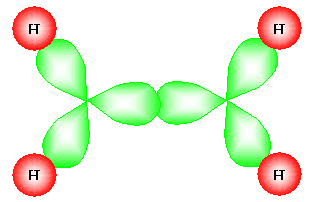
يحدث
الترابط بين ذرتي هيدروجين ( فلك I1s
) مع فلكين من أفلاك
sp2 في ذرة الكربون , أما الفلك
الثالث فيرتبط مع الفلك الثالث في ذرة الكربون الثانية . إذن
تتشكل ثلاث روابط من نوع سكما . أما الرابطة المزدوجة الثانية بين ذرتي الكربون
فتنشأ عن تداخل مداري p مع بعضهما باتجاه عمودي
على الخط الواصل بين نواتي
الذرتين
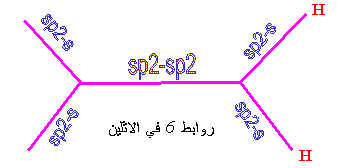
|
|
