|
البنية الالكترونية للذرة
مزايا الأفلاك الهجينة
(2)
|
|
تهجين sp3
:
دراسة جزيء النشادر ( الأمونيا )
NH3
أ-ما الذرة المركزية في جزيء النشادر ؟
ب-اكتب التوزيع الإلكتروني لذرة النيتروجين
( الذرة
المركزية
)
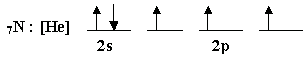
ج- إذا حدث في هذه الذرة
تهيجياً من نوع sp3 فاكتب التوزيع للإلكترونات الخارجية بعد
التهجين
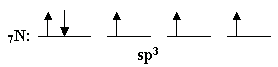
د- يحدث الترابط بين فلك I
1s
لكل ذرة من ذرات الهيدروجين
الثلاث وثلاثة من أفلاك
sp3
في ذرة
النيتروجين , أما الفلك الرابع فلا يشترك في الربط
(
لماذا
؟
).
هـ- اكتب
صيغة
NH3
بطريقة لويس موضحا طريقة الارتباط
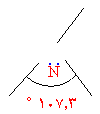
و- ما شكل جزيء الأمونيا
الفراغي ؟ إنه هرم ثلاثي
وهو حالة خاصة من رباعي الأوجه المنتظم وذلك لوجود زوج إلكتروني مزدوج ولم يشترك في الربط
.
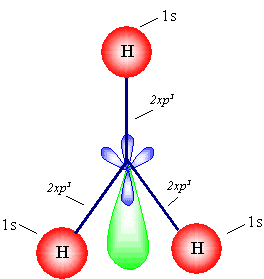
ز- يتضح من الشكل أعلاه جميع الروابط هي من
نوع
سكما
وأن وجود
الإلكترونين المزدوجينوغير المرتبطتين على
الفلك sp3
الرابع يكمل رباعي الأوجه المنتظم.
يسمى زوج الإلكترونات غير المرتبط باسم
" الزوج الطليق "
.
|
