|
 مثال
:
مثال
:
البيريدين
C5H5N
قاعدة ضعيفة اكتشفت في قطران الفحم ، فإذا علمت أن
Kb
=ه1.5
× 10-9 . احسب
PH
لمحلول من البيريدين تركيزه ( 0.1 مول / لتر ) . علماً بأن معادلة التأين :
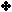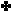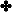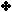 الجواب
:
الجواب
:
أ-
نكتب معادلة التأين للقاعدة الضعيفة :
|
 |
التركيز مول / لتر |
|
( 0.01
) |
صفر |
صفر |
بداية التفاعل |
|
( - س ) |
( + س ) |
( + س ) |
مقدار التغير |
|
( 0.01
- س ) |
( س ) |
( س ) |
عند الاتزان |
ب-
بالتعويض في تعبير ثابت التأين
Kb
|
 |
| |
|
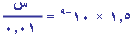 |
|
1.5 × 10-9 ×
0.01 = س2، وبأخذ الجذر التربيعي
للطرفين |
|
س = 3.87 × 10-6
مول / لتر |
|
وبالتالي
[-OH] =ه3.87
× 10 -6
مول / لتر |
ج-
لحساب PH
بدلاً من حساب
[+H3O]
إذاً :
|
Kw =
[-OH]ه
[+H3O] |
|
1 × 10-14
=
[+H3O]
ه( 3.87 × 10-6
) مول / لتر |
|
|
|
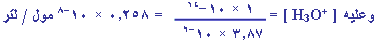 |
|
|
|
وبالتالي
PH
= - لو [
H3O+
]
= - لو 0.258 × 10-8 = 8.6 |
|

