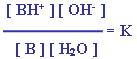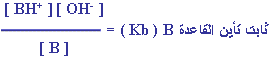|
 الاتزان في
محاليل القواعد الضعيفة
الاتزان في
محاليل القواعد الضعيفة
إذا رمزنا لقاعدة ضعيفة
B
فإنه يمكن تمثيل معادلة تأينه كما يلي :
|
لذلك يمكن التعبير عن ثابت الاتزان كما يلي : |
 |
| |
|
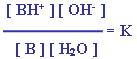 |
وبما أن [
H2O
] في المحاليل لايتغير بدرجة كبيرة ، فيمكن اعتبار تركيزه قيمة ثابتة
ودمجه في ثابت جديد كما يلي :
إذاً :
ولذلك يكون لكل قاعدة من القواعد الضعيفة قيمة محددة لـ
Kb عند ( 25 ْ س ).
 سؤال :
سؤال :
يعتبر
Kb مقياساً لقوة
القاعدة ( وضح ذلك ) ؟؟.
 سؤال :
سؤال :
إذا علمت أن
Kb
للقاعدة
NH3
=ه1.8
×
10-5
،
Kb
للقاعدة
NH3
=ه1
×
10-6
( عند 25 ْ س )
أجب عما يلي :
1- أيهما أقوى كقاعدة ؟
2-
أيهما
]
OH-
[
فيه أكبر ( محاليل متساوية التركيز ) ؟
3-
أيهما
]
H3O+
[
فيه أكبر ( محاليل متساوية التركيز ) ؟
4-
أيهما
تكون قيمة
PH له أكبر ( محاليل متساوية التركيز ) ؟
 سؤال
:
سؤال
:
إذا كان لديك
محلولين
متساويين في التركيز أحدهما
KOH
والآخر
NH3
أيهما تكون
PH
له أكبر ( وضح )؟
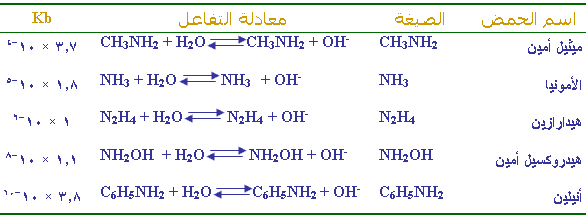
ويبين
الجدول
التالي
قيم ثابت
التأين لعدد من القواعد الضعيفة عند ( 25 ْ س ) :
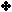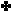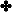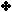 سؤال
:
سؤال
:
بالرجوع للجدول
السابق أجب عما يأتي
:
1 - اكتب تعبير ثابت الاتزان
Kb
لتفاعل ميثيل أمين مع الماء ؟
2- أيهما أقوى كقاعدة : ميثيل أمين أم الأمونيا ؟
3- قارن
]
OH-
[
في محاليل
متساوية التركيز من
NaOH
،
HN2H4
،
NH3.
|