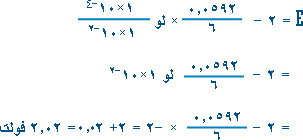|
||||||||||||||||||||||
|
2) الفلزان هما الفضة والنحاس . 3) العناصر التي تستطيع تحرير الهيدروجين من مركباته هما عنصري الخارصين والألمنيوم .
ب) 1) جهد الخلية المعياري = 0.34 – (-1.66) = 0.34 + 1.66 = 2.00 فولت 2) التفاعل الكلي للخلية :
وبعد الموازنة والتعديل ليصبح عدد الالكترونات المفقودة = عدد الالكترونات المكتسبة .
3) العامل المؤكسد هو أيون النحاس Cu+2 . 4) تنقص كتلة قطب الألمنيوم مع مرور الزمن . 5) تتجه أيونات -NO3 إلى وعاء الألمنيوم .
حيث E0 جهد الخلية المعياري. ن عدد الالكترونات المنتقلة من العامل المختزل إلى العامل المؤكسد j هي ناتج قسمة تراكيز المواد الناتجة على تراكيز المواد المتفاعلة.
|
||||||||||||||||||||||
|
Copyright © 2001 - 2010 SchoolArabia. All rights reserved الحقوق القانونية وحقوق الملكية الفكرية محفوظة للمدرسة العربية |
||||||||||||||||||||||