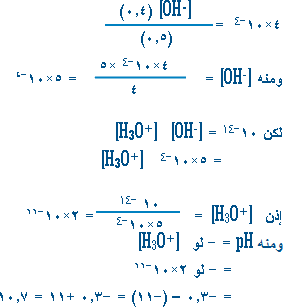|
||||||||||||||||
|
ب) 2) أقوى قاعدة مرافقة هي CIO- وهي القاعدة المرافقة لأضعف حمض. 3) إذا تساوت تركيز الحموض الثلاثة فإن أقل قيمة pH ستون لأقواها وهو HNO2 .
ج) 2) لحساب pH لمحلول نكتب أولاً معادلتي تحلل CH3NH2 ، CH3NH3CI في الماء.
هنا نعتبر التفكك كاملاً لأن ملح CH3NH3CI يشبه الأملاح الأيونية في تفككه على الرغم من روابطه المشتركة. وبما أن تفكك القاعدة ضعيف إذن نعتبر تركيز CH3NH2 عند الاتزان هو ذاته التركيز الابتدائي أي 0.5 مول/لتر . تركيز أيون CH3NH3+ في المحلول ناتج عن تأين الملح وعن تفكك القاعدة ، والكمية الناتجة عن تفكك القاعدة صغيرة جداً تكاد لا تذكر بالمقارنة مع الكمية الكبيرة لهذا الأيون الناتجة عن التأين الكامل للملح ، إذن نعتبر تركيز CH3NH3+ عند الاتزان هو تركيز الملح . إذن يمكن الآن أن نعوض في معادلة ثابت تفككCH3NH2
|
||||||||||||||||
|
Copyright © 2001 - 2010 SchoolArabia. All rights reserved الحقوق القانونية وحقوق الملكية الفكرية محفوظة للمدرسة العربية |
||||||||||||||||