|
المنهاج الأردني |
الثانوية العامة
(الثاني الثانوي العلمي)
|
|
امتحان شهادة
الدراسة الثانوية العامة لعام 2002 |
 السؤال
الخامس :
السؤال
الخامس :
أ)
وازن معادلة التفاعل الآتي بطريقة نصف التفاعل ( أيون ـ إلكترون ) في وسط حمضي
. ثم حدد العامل المؤكسد والعامل المختزل فيها :
ب)
1. في محلول HF
تركيزه ( 0.1 مول / لتر ) كان تركيز
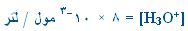 . احسب قيمة Ka
لهذا الحمض .
. احسب قيمة Ka
لهذا الحمض .
2. إذا أضيف الى لتر من المحلول السابق ( 0.64 مول )
من ملح
NaF
، احسب قيمة
(
pH )
للمحلول الناتج .
(أهمل التغير في حجم المحلول ) .
|
 |
ج) |
(
Mg , HCl
, إيثر ,
H2SO4
مركز ساخن )
. وضح بالمعادلات فقط كيفية تحضير مركب البروبين .
إجابة السؤال
 السؤال السادس :
السؤال السادس :
|
Kb |
القاعدة |
|
1.5 × 10-9 |
A |
|
3.7 × 10-4 |
B |
|
1.0 × 10-8 |
C |
|
أ)
يبين الجدول المجاور قيم
Kb
لمحاليل بعض القواعد الضعيفة المتساوية في التركيز . اعتماداً على
الجدول أجب عما يأتي :
1. أي من محاليل القواعد له أقل قيمة ( pH
) ؟
2. أي من محاليل القواعد يتفاعل بدرجة أكبر مع الماء ؟
3. أكتب معادلة تفاعل القاعدة (A)
مع الماء ثم حدد الزوجين المترافقين من الحمض والقاعدة . |
4.
احسب (pH
) في محلول تركيزه ( 0.01 مول / لتر ) من القاعدة C.
5. رتب الحموض المرافقة للقواعد السابقة حسب تزايد
قوتها .
ب)
اكتب الناتج العضوي في كل من التفاعلات الآتية :
إجابة السؤال
