
|
المنهاج الأردني |
الثانوية العامة
(الثاني الثانوي العلمي)
|
|
امتحان شهادة الدراسة
الثانوية العامة لعام 2000 |
 السؤال الرابع :
السؤال الرابع :
أ)
ما نوع قوى التجاذب الرئيسة بين جزيئات كل من المركبات الآتية في الحالة
السائلة :
|
3.
CBr4 |
2.
CH3COOH |
1.
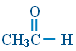 |
ب)
لديك المواد الآتية في الحالة السائلة (
HI , HF , HBr)
أجب عما يأتي :
1. أيها أسرع
تبخراً ؟
2. أيها تمتلك جزيئاته طاقة تبخر أعلى؟
3.
تحت أي صنف من البلورات الصلبة يتبلور ( HI)
؟ 4. أيهما له أعلى طاقة تكاثف (
HBr
أم HI)
؟
 السؤال الخامس :
السؤال الخامس :
أ)
يتم التفاعل الآتي في وسط حمضي , انقله إلى دفتر إجابتك وأجب عن الأسئلة التي
تليه :
1. وازن المعادلة
بطريقة نصف التفاعل ( أيون ـ الكترون )
.
2.
حدد العامل المؤكسد .
3. ما عدد تأكسد
اليود في الأيون ( IO3-)
؟
ب)
فسر السلوك الحمضي لأيون ( NH4+)
وفق مفهوم برونستد ـ لوري للحمض .
ج)
تم استخدام عدد من الأقطاب الفلزية ومحاليها
المائية (1 مول / لتر ) لعمل خلايا غلفانية مختلفة في
الظروف المعيارية , كما في الجدو ل (1) , كما يبين الجدول (2) جهود
الإختزال المعيارية لعدد من أنصاف التفاعلات:
|
ُE
( فولت) |
نصف تفاعل الإختزال |
|
- 0.25 |
Ni2+ (aq) + 2e-
 Ni (s)
Ni (s) |
|
- 0.76 |
Zn2+(aq)
+ 2e-
 Zn (s)
Zn (s) |
|
+0.80 |
Ag+(aq)
+ e-
 Ag (s)
Ag (s) |
|
+0.34 |
Cu2+
(aq) + 2e-
 Cu
(s) Cu
(s) |
|
- 1.66 |
Al3+
(aq) + 3e-  Al (s)
Al (s) |
|
|
|
القطب
(B) |
القطب (A) |
رقم الخلية |
|
Zn |
Ni |
1 |
|
Ag |
Cu |
2 |
|
Ni |
Al |
3 |
|
Cu |
Zn |
4 |
|
 اعتماداً
على المعلومات في الجدولين : (1 , 2) أجب عما يأتي
:
اعتماداً
على المعلومات في الجدولين : (1 , 2) أجب عما يأتي
:
1. أي القطبين (
A
أم
B)
يُمثل المصعد في الخلية رقم (1) ؟
2. ما رقم الخلية التي لها أقل قيمة جهد
(
(ُُْ
E
؟
3.
ماذا يحدث لكتلة القطب (
B)
في الخلية رقم (3) ؟
4. أي الأيونات (
Al3+
, Ni2+
, Ag+
) أقوى كعامل مؤكسد ؟
5. باستخدام الجدول (2) اختر فلزين لعمل خلية لها أعلى جهد
(
(ْE
, واكتب معادلة التفاعل الكلي لهذه الخلية .
إجابة السؤال