|
الحالة
الغازية إجابات (8)
|
|
قانون
دالتون للضغوط الجزئية
أ-
ماذا حدث لدرجة الحرارة في السؤال
؟
لم يحدث أي تغيير .
ب-
ما دامت درجة الحرارة لم تتغير إذن بقيت العلاقة بين الحجم
والضغط .
ج- بالنسبة لغاز He
فإن 500 × 120 = 600×
ض2
إذن الضغط ( ض2 ) للهيليوم في وعاء
المزيج

د- وبطريقة مشابهة ضغط غاز
الكريبتون في وعاء المزيج
=
180
ملم زئبق
هـ-
الضغط الكلي في وعاء المزيج
= ضغط
He + ضغط Kr
= 100 + 180
= 280 ملم زئبق
أجب عما يلي :

2- الأعلى في ضغطه في الوعاء الثاني هو غاز
SO2
لأن
عدد مولاته 6 وهي أكبر من
عدد مولات
N2
(عددها 4
) .
3- أقلها في ضغطه هو أقلها في عدد مولاته وهذا ينطبق على غاز
الهيليوم في الوعاء الرابع.
أ- ضغط SO2
في الوعاء الثاني = الكسر المولي للغاز × الضغط الكلي
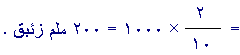
ب-
ضغط
CO2
الجزئي في
الوعاء الثالث
=( 2 /10 )× 1000 = 200 ملم
زئبق.

رجوع
|
