|
سرعة
التفاعل الكيميائي وآلية التفاعل
سرعة التفاعل والعوامل المؤثرة
فيه
إجابات
التدريبات
|
|
ج
1 :
أ- الثانية
ب- الثانية
ج- الرتبة كسرية 1.5
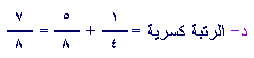
ج2 :
أ- من الاختبار
الأول والثاني : ضاعفنا [J] مرتين فتضاعفت السرعة
مرتين
( تركيز G بقي كما هو في الاختبارين )
، إذن التفاعل هو من المرتبة الأولى بالنسبة لمادة J
.
وإذا أخذنا الاختبار الأول والثالث حيث تركيز J لم يتغير ، بينما ضاعفنا تركيز
G
ه3 مرات وبقيت السرعة نفسها ، إذن تركيز
G
لا يؤثر على سرعة التفاعل ، أي أن التفاعل هو من المرتبة صفر
بالنسبة لـِ G .
إذن قانون السرعة
R = هk ×ه[G] × 1[J]صفر
= k ×
ه[J]
ب- التفاعل من الدرجة الأولى .
ج- حساب قيمة ثابت السرعة ، نأخذ قيم
أي واحد من الاختبارات الثلاث ولنأخذ الاختبار الثاني
R ه = k × ه[J]
1 × 10-3 = k ه
× 2 ×10-1

د- سرعة التفاعل تعتمد على تركيز J فقط كما اتضح لنا من الفرع
أ
R ه =
k × ه[J]
= 5 × 10-3
× 2 × 10-2 = 10-4 مول / لتر . ث
رجوع
|
|
