|
سرعة التفاعل
الكيميائي وآلية التفاعل
سرعة التفاعل والعوامل المؤثرة
فيه
إجابات الاختبار القبلي
(2)
|
|
إجابات
السؤال الثالث :
تحليل السؤال
أ- إذا درست البيانات ستجد أن الفرق
بين [A] في التجربتين الثالثة والثانية قد تغير من 10-1
مول / لتر إلى 2 × 10-1 مول
/ لتر أي انه قد تضاعف ، بينما بقي تركيز B ثابتا وهو2 × 10-1 و
نتيجة تغيير تركيز A تضاعفت السرعة أيضاً ، إذن بالنسبة لتركيز A العلاقة هي :
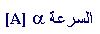
وإذا
أخذت التجربتين 2 ، 4
تجد أن تركيز A فيها لم يتغير ، أما تركيز B فقد تضاعف من 2×10-1 إلى 4×10-1 . ونتيجة لهذا
التغيير تضاعفت السرعة أربع مرات (من 2 إلى 8) إذن

إذن السرعة = k
[هA ] [هB ]هi2
ب- رتبة التفاعل : هي الرتبة الثالثة وهي عبارة عن حاصل
جمع قوى تراكيز المواد الداخلة في قانون السرعة 1+2=3
جـ- لحساب ثابت السرعة نأخذ أرقام
أي تجربة من التجارب المعطاة ، ولنأخذ التجربة (1)
السرعة = k
[هA ] [هB
]هi2
2.5 × 10-1 = k ه( 10-1 ) (10-1
)2
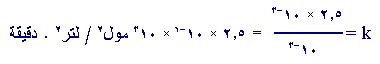
ولو
أخذت أي تجربة من التجارب الثلاث الأخرى لوجدت أن k =250
د- لحساب سرعة التفاعل : أصبحت كل
القيم اللازمة معروفة التراكيز
معطاة والثابت حسبناه في
الفرع السابق ، وقانون السرعة استخرجناه في
الفرع أ ، إذن:
السرعة = k [هA ] [هB ]هi2
= 250 × 1 × ( 0.5 )2 = 1250 × 1 × 0.25
= 62.50
مول من C / لتر
. دقيقة
رجوع
|
|
