|
البنية
الالكترونية للذرة
الكهروسلبية وقطبية الرابطة
(1)
|
|
من الطبيعي أن تختلف ذرات العناصر المعروفة في
قدرتها على جذب الإلكترونات عندما ترتبط الواحدة منها بالأخرى
برابطة مشتركة . وسيظهر هذا الاختلاف في الكثير من الروابط التي
تجمع بين ذرتين من نوعين مختلفين , لنأخذ على سبيل المثال جزيء
غاز HCl
,
حيث الرابطة المشتركة بين
الهيدروجين والكلور , ودراسة خواص هذا المركب تبين لنا أن الكلور يحمل شحنة سالبة صغيرة , ويحمل الهيدروجين شحنة موجبة صغيرة . تدل هذه
الخاصية على أن إلكتروني الربط أقرب إلى ذرة الكلور منها إلى ذرة
الهيدروجين , وهذا
يدل على أن رغبة وقدرة ذرة الكلور على جذب إلكتروني الرابطة
المشتركة أكبر من تلك التي لذرة الهيدروجين .
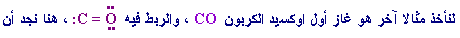
إلكترونات الربط تميل نحو
الاوكسيجين لأنه أقدر على جذبها من ذرة الكربون . ينطبق الكلام
نفسه على الكثير من المركبات مثل PBr3 , HI2 , Cl2O
وغيرها .
تدعى
قدرة الذرة على جذب الإلكترونات في
الرابطة المشتركة لنفسها باسم الكهروسلبية . تختلف الكهروسلبية من عنصر
لآخر فإذا كانت القدرة على جذب الإلكترونات كبيرة كانت الذرة
عالية الكهروسلبية , وإذا كانت هذه القدرة منخفضة كانت الذرة
قليلة الكهروسلبية .
تدعى المركبات مثل HCl , و CO , و HI ومثيلاتها باسم المركبات
القطبية ذلك لأن للواحد منها قطبان : قطب سالب ( هو الكلور في
حالة HCl) وقطب موجب
( هو الهيدروجين في مثال HCl )
.
|
|
