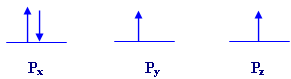|
|||||||||||||||||||
تحديد التركيب الإلكتروني للعنصر
إذن المستوى الفرعي
i4s
يمتلئ قبل المستوى الفرعي
i3d.نعتمد
هنا على المجموع فالمجموع الأقل يعطي للمستوى طاقة أقل.
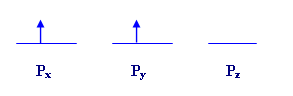
يحتل الإلكترونان
فلكين من الثلاثة على أن يكون لهما نفس اتجاه الدوران وبذلك يكون الشكل
يمثل كل سهم إلكترون واحد مع اتجاه دورانه
.
نص قاعدة هوند
:
حينما تمتليء أفلاك مستوى فرعي واحد فإن الإلكترونات تتوزع
فيها فرادى وبنفس اتجاه الدوران ، وتبدأ
هذه الإلكترونات بالازدواج بعد أن يصبح المستوى الفرعي نصف ممتليء
.
اعداد : أ. سليم حمام
تحرير : المدرسة
العربية
www.schoolarabia.net
تاريخ التحديث :
تاريخ التحديث : حزيران 2008 |
|||||||||||||||||||
|
Copyright © 2001 - 2010 SchoolArabia. All rights reserved الحقوق القانونية و حقوق الملكية الفكرية محفوظة للمدرسة العربية |
|||||||||||||||||||