|
 أهمّية مفهوم لويس
أهمّية مفهوم لويس
1-
تفسير
تفاعلات لا تشمل انتقال بروتونات.
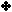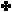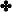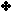 مثال :
مثال :
لنفسّرهذا التفاعل وفق مفهوم لويس
ندرس الجزيء
BF3
: فهو مثلث مسطح، وتهجين الذرة المركزية
SP2
. كما أن عدد الإلكترونات في مستوى التكافؤ للذرة المركزية (B)
يحتوي (6) إلكترونات ( لم يحقق قاعدة الثمانية ) لذلك فبإمكان البورون أن
يستقبل زوج من الإلكترونات في فلك ( أ ) غير المهجّن والمتعامد مع سطح الجزيء.
لذلك فهو حمض لويس.
أما الجزيء
NH3
: فهو هرمي ثلاثي، ويمتلك زوج من الإلكترونات غير المرتبطة
الموجودة في الفلك المهجّن
SP3
وعليه فإن الذرة المركزية قادرة على منح زوج من
الإلكترونات.لذلك فهو قاعدة لويس. دقق في التفاعل التالي :
|
كيف
تفسر التفاعل التالي وفق مفهوم لويس :
 |
2-
تُعد الأيونات الموجبة للفلزات ( وخاصة الانتقالية
) حموض لويس
(أمثلة :
Ag+
،
Cd2+
،
CO3+
) ( فسِّر
).
3-
تُعد الأيونات السالبة مثل
–Cl
، -Br
(
- X
هاليد
) قواعد لويس. ( فسِّر ).
4- تُعد الجزئيات
H2O ، NH3
من حموض وقواعد لويس. ( فسِّر
).
 تدريب :
تدريب :
حدِّد حموض أو قواعد لويس في كل من التفاعلات الآتية :
|

