|
 من المعادلة الموزونة نفهم أنه كلما تفاعل
i2i
مول من
H2
ينتج
i2i مول من الماء, إذن يمكن أن نستنتج أنه إذا تفاعل مول واحد من
H2 واحد من
H2O.
والآن لنعد إلى سؤالنا : كم مولاً من
H2 موجودة في
i2i
غم هيدروجين؟ من المعادلة الموزونة نفهم أنه كلما تفاعل
i2i
مول من
H2
ينتج
i2i مول من الماء, إذن يمكن أن نستنتج أنه إذا تفاعل مول واحد من
H2 واحد من
H2O.
والآن لنعد إلى سؤالنا : كم مولاً من
H2 موجودة في
i2i
غم هيدروجين؟
وزن المول من
H2
ه
=
i2i=
i1i
× i2i
غم.
إذن
i2i غم هيدروجين هي عبارة عن مول واحد, وعندما يتفاعل مول واحد من
الهيدروجين ينتج مول واحد من الماء.
وزن المول من الماء =
(i16i
×i1i
) + (i1i
×i2i
)
إذن
عند تفاعل
I2I غم هيدروجين مع الأوكسجين ينتج
i18i
غم ماء.
اقترح طرقاً أخرى
للحل.
 استعملنا عبارة " كمية زائدة " لنؤكد على أنه يوجد كمية من الهيدروجين تسمح
باستهلاك كل كمية الأوكسجين المتفاعلة وهي
i7.5i
مولاً.
استعملنا عبارة " كمية زائدة " لنؤكد على أنه يوجد كمية من الهيدروجين تسمح
باستهلاك كل كمية الأوكسجين المتفاعلة وهي
i7.5i
مولاً.
من المعادلة نفهم أنه كلما تفاعل مول واحد من الأوكسجين , ينتج
i2i
مول من الماء. كم عدد مولات الماء الناتجة إذن ؟
الجواب : عدد مولات
الماء =
i2i × عدد مولات الأوكسجين.
=
i15i
=
i7.5i
×
i2i
مولاً من الماء.
 تحليل السؤال (51):
تحليل السؤال (51):
|
H2(g)
+ O2(g) |
 |
H2O(l) |
المعادلة
الموزنة |
|
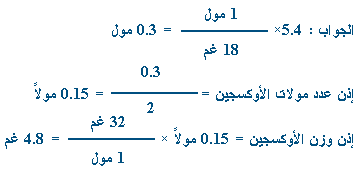
ـ
من المعادلة كل مول من
O2
(i32i)
غم ينتج مولين من الماء (
i36iغم)
.
ـ
كم عدد مولات الماء المعطاة في السؤال ؟ |
|
 |
جرب بنفسك أن تجد طرقاً أخرى للحل.
|

