|
القسم الثالث :
ـ
ما صيغة اوكسيد الحديد (III)
؟
الجواب
:
Fe2O3
ما وزن المول من
Fe2O3
؟
الجواب
=
(i16i
×
i3i)
+ (
i56i
×
i2i
)
=
i160i
+
i48i
+
i112i
غم
ـ
تحليل السؤال
:
ـ
ما
العناصر التي تدخل في تكوين المركب ؟
الجواب
: الكربون والكبريت .
ـ
ما معنى أن نسبة الكربون
i15.8i
%
؟
الجواب
:
المعنى أنه في كل
i100iغم
من المركب يوجد
i15.8i
غم كربون .
ـ كم كمية الكبريت في
i100i
غم من المركب ؟
الجواب
: يوجد في i100i
غم من المركب كمية من الكبريت مقدارها
.
i84.2i
=
i15.8i
–
i100i
غم
|
حتى نكتشف الصيغة نحول الغرامات إلى مولات لأن الصيغة تكتب بالمولات
. |
|
 |
إذن
الصيغة Cl1.32S2.63 وحتى نحول الكسور إلى أعداد
صحيحة نقسم على العدد الأصغر منها وهو
I1.32I
فنحصل على الصيغة CS2 وهي صيغة المركب المطلوب إيجادها , ولمزيد
من التوضيح :
|
 |
|
إذن
الصيغة CS2 |
ـ تحليل السؤال:
من الواضح أن السؤال أن صيغة المركب بالغرامات معطاة في نص السؤال, ولكن
الصيغ الغرامية لا تستخدم في التعبير عن المركبات بل تستخدم الصيغ المولية,
لذلك المطلوب منا هو تحويل الغرامات من كل عنصر إلى مولات ومن ثم
تحويل الكسور إلى أعداد صحيحة.
ـ كم مجموع وزن البوتاسيوم والنيتروجين في العينة؟
الجواب
: الوزن =i0.18i
=
i0.05i
+
i0.13i
غم
ـ ما وزن الأوكسجين في العينة؟
الجواب
:
i0.34i
ـ
i0.16i
=
i0.18i
غم.
|
ـ
كم
عدد مولات البوتاسيوم ؟ |
|
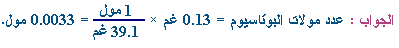 |
|
وللحصول على عدد مولات كبير نضرب الناتج
في
i100i
فينتج i0.33i
=
i100i
×
i0.0033i
مول |
|
ـ
كم
عدد مولات النيتروجين ؟ |
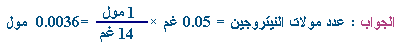 |
نضرب في
i100i
كما عملنا مع البوتاسيوم فيكون الناتج :
i0.36i
=
i100i
×
i0.0036i
مول |
|
نقوم بالأمر نفسه مع الأوكسجين |
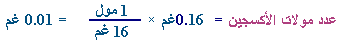 |
|
عدد مولات
الأوكسجين ×
100
=
i1i
=
i100i
×
i0.01i
مول |
|
إذن
صيغة المركب =
K0.33N0.36O1 |
وبقسمة
الأعداد كلها على
i0.33i
ينتج :
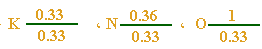
|
|
إذن صيغة المركب =
KNO3 |
|

