قاعدة
Base
مركب يمتاز بالصفات
الآتية :
1. لها طعم مر .
2. تغير لون صبغة عباد الشمس الى اللون الأزرق .
3. لها ملمس انزلاقي كالصابون .
4. محلولها
المائي موصل للتيار الكهربائي
رجوع
Back
قاعدة أرهينيوس
Arrhenius base
مادة إذا أذيبت في الماء أعطت
أيونات الهيدروكسيد
OH
.
يشترط أرهينيوس في القاعدة الشرطين الآتيين :
1-
أن تذاب في الماء .
2-
أن تحتوي على أيون الهيدروكسيد .
من الأمثلة على قواعد أرهينيوس :
ـ
هيدروكسيد الصوديوم
NaOH
.
ـ
هيدروكسيد البوتاسيوم
KOH
.
رجوع
Back
قاعدة الثمانية
Octet
rule
تشارك
غالبية الذرات بالإكترونات للوصول نتيجة الترابط الى ثمانية الكترونات في
مستوى الطاقة الأخير لذرتها ، فتصبح بذلك مستقرة الكترونياً .
رجوع
Back
قاعدة برونستد ـ لوري
Bronsted
ـ
Lowry base
مادة لها القدرة على استقبال بروتون من مادة أخرى .
من الأمثلة على قواعد برونستد - لوري :
-
هيدروكسيد الصوديوم
NaOH
.
-
هيدروكسيد البوتاسيوم
KOH
.
-
أمونيا
NH3
.
رجوع
Back
قاعدة ضعيفة
Weak Base
قاعدة تتفكك جزئياً عند اذابتها في الماء ، وتكون ايصالية محلولها المائي
للتيار الكهربائي ضعيفة .من الأمثلة عليها الأمونيا
NH3
.
رجوع
Back
قاعدة قوية
Strong base
قاعدة تتفكك كلياً عند اذابتها في الماء ، وتكون ايصالية محلولها المائي للتيار
الكهربائي عالية
.
من الأمثلة عليها هيدروكسيد الصوديوم
NaOH
.
رجوع
Back
قاعدة لويس
Lewis
base
مادة لها القدرة على منح زوج من الإلكترونات غير رابطة أو أكثر من الأمثلة على قواعد لويس :
-
هيدروكسيد الصوديوم
NaOH
.
-
هيدروكسيد البوتاسيوم
KOH
.
-
أمونيا
NH3
.
رجوع
Back
قاعدة ماركوفينيكوف
Markovinikoffs rule
عند إضافة متفاعل قطبي للرابطة الثنائية أو الثلاثية تضاف ذرة الهيدروجين
الى ذرة كربون الرابطة الثنائية أو الثلاثية الحاوية على أكبر عدد من
ذرات الهيدروجين .
رجوع
Back
قاعدة مرافقة ( مقترنة )
Conjugate base
القاعدة
الذي تنشأ من منح حمض برونستد- لوري لبروتون .
|
 |
مثال : |
رجوع
Back
قاعدة هوند
Hunds rule
تتوزع الإلكترونات على أفلاك المستوى الفرعي الواحد بحيث يكون مجموع
الالكترونات المنفردة أكبر ما يمكن .
رجوع
Back
قانون التخفيف
Dilution
law
علاقة رياضية تشتق من فكرة أن عدد مولات المذاب لا تتغير أثناء تخفيف المحلول .
عدد مولات
المذاب قبل التخفيف = عدد مولات المذاب بعد التخفيف
( التركيز ×
الحجم ) قبل التتخفيف = ( التركيز × الحجم ) بعد التخفيف
رجوع
Back
القانون الجامع
Combined Law
قانون يجمع بين قانون بويل وقانون شارل وقانون غايلوساك
في قانون واحد .
وينص القانون على أن حجم عينة غازية يتناسب طردياً مع درجة حرارتها المطلقة
وعكسياً مع الضغط الواقع عليها .
 |
|
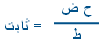 |
أو |
 |
|
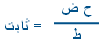 |
أو |
عند ح1 و ض1 و ط1 يكون :
عند ح2 و ض2 و ط2 يكون :
وعليه يكون :
حيث :
ح : حجم الغاز ويقاس بعدة وحدات منها اللتر , سم3 , دسم , وغيرها .
ض : ضغط الغاز ويقاس بعدة وحدات منها مم زئبق , ضغط جوي , تور , باسكال ,
وغيرها .
ط : درجة الحرارة المطلقة ووحدتها الكلفن .
رجوع
Back
قانون السرعة
Rate Law
تتناسب
سرعة التفاعل تناسباً طردياً
مع تراكيز المواد المتفاعلة في تفاعل ما
،
ويرفع كل تركيز للقوة رتبة التفاعل بالنسبة لتلك المادة المتفاعلة .
رجوع
Back
قانون الغاز المثالي
Ideal
Gas Low
حجم عينة غازية تحتوي على ( ع ) مول تتناسب طردياً مع درجة حرارتها المطلقة
،
وطردياً مع عدد مولاتها ، وعكسياً مع الضغط الواقع عليها.
أو ض × ح = ثابت × ع × ط
ويرمز للثابت بالرمز ( ر ) ويسمى ثابت الغاز العالمي .
وعليه تصبح العلاقة :
ض ح = ر ع ط
حيث :
ض : ضغط الغاز ووحدته تتناسب مع وحدة الثابت ( ر ).
ح : حجم الغاز ووحدته تتناسب مع وحدة الثابت ( ر ).
ر : ثابت الغاز العالمي .
ع : عدد المولات ويقاس بالمول .
ط : درجة الحرارة المطلقة ووحدتها الكلفن .
رجوع
Back
قانون النسب الثابتة
Definite
Proportion Law
يتكون
المركب دائماً من عناصر متحدة مع بعضها بنسب كتلية ثابتة .
رجوع
Back
قانون النسب المتضاعفة
إذا اتحد عنصران وكونا أكثر من مركب واحد ، فإن النسبة بين الكتل المختلفة من
أحد العنصرين التي تتحد مع كتلة ثابتة من العنصر الآخر تكون نسبة عددية صحيحة
بسيطة .
رجوع
قانون بويل
Boyle’s Law
قانون ينص على أن حجم عينة غازية عند درجة حرارة ثابتة يتناسب عكسياً مع الضغط
الواقع عليها .
|
عند ثبوت درجة الحرارة |
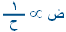 |
أو ض ح = ثابت
عند ض1 و ح1 يكون :
ض1 ح1 = ثابت
عند ض2 و ح2
يكون :
ض2 ح2 = ثابت
وعليه يكون :
ض1 ح1 = ض2 ح2
حيث :
ض : ضغط الغاز ويقاس بعدة وحدات منها مم زئبق ، ضغط جوي ، تور ،
باسكال ، وغيرها .
ح : حجم الغاز ويقاس بعدة وحدات منها اللتر ،, سم3 ، دسم ، وغيرها .
رجوع
Back
قانون دالتون للضغوط الجزئية
Daltons
law of partial pressure
الضغط الكلي
لخليط من الغازات التي لا تتفاعل مع بعضها يساوي مجموع الضغوط الجزئية للخليط
رجوع
Back
قانون شارل
Charle’s Law
قانون ينص على أن حجم عينة غازية عند ضغط ثابت يتناسب طردياً مع درجة
الحرارة المطلقة .
ح µ ط عند ثبوت الضغط
عند ح1 و ط1 يكون :
عند ح2 و ط2 يكون :
وعليه يكون :
حيث :
ح : حجم الغاز ويقاس بعدة وحدات منها اللتر ، سم3 ، دسم ، غيرها .
ط : درجة الحرارة المطلقة ، ووحدتها الكلفن .
رجوع
Back
قانون غايلوساك
Gay _ Lussac’s Law
قانون ينص على أن ضغط عينة غازية عند حجم ثابت يتناسب طردياً مع درجة
الحرارة المطلقة .
ض
µ ط عند ثبوت الحجم
عند ض1 و ط1 يكون :
عند ض2 و ط2 يكون :
وعليه يكون :
حيث :
ض : ضغط الغاز ويقاس بعدة وحدات منها مم زئبق ، ضغط جوي ، تور ، باسكال ،
وغيرها .
ط : درجة الحرارة المطلقة ، ووحدتها الكلفن .
رجوع
Back
قانون غراهام للانتشار والتدفق
Grahams law of diffusion and effusion
قانون ينص على
أن سرعة تدفق غاز تتناسب عكسياً مع الجذر التربيعي لكثافته أو كتلته المولية .
رجوع
Back
قانون هنري
Henrys Law
:
تتناسب
ذائبية الغاز طردياً مع ضغط الغاز فوق سطح السائل .
رجوع
Back
قصر الألوان
Bleaching
إزالة لون المادة عن طريق تأكسدها أو اختزالها بأحد العوامل المؤكسدة أو
المختزلة .
يستخدم لقصر الألوان العديد من المواد ومنها :
ـ فوق أكسيد الهيدروجين H2O2
.
ـ هيبوكلوريت الصوديوم NaOCl .
ـ ثاني أكسيد الكبريتSO2
.
رجوع
Back
قطب الهيدروجين المعياري
Standard hydrogen electrode
نصف
تفاعل خلوي للهيدروجين اعتبر جهده الاختزالي صفراً واتخذ أساساً لمقارنة
جهود أنصاف التفاعلات الأخرى .
رجوع
Back
قطب خامل
Inert
electrode
قطب لا يشارك
في عمليتي التأكسد والإختزال في خلايا التحليل الكهربائي مثل الغرافيت
والبلاتين .
رجوع
Back
قطن
Cotton
صورة نقية من السليلوز ، تتكون في أزهار شجرة القطن ، حيث تقطف وتخلص من البذور
والأوساخ في المحالج ، وتغزل في خيوط يستعمل لنسج الأقمشة القطنية .
يصنع من القطن مادة متفجرة تسمى نيتروسيليلوز .
رجوع
Back
|
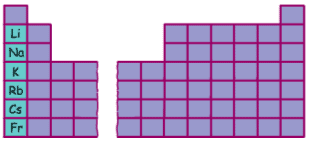 |
قلويات
Alkaline metals
عناصر فلزية تنتمي الى المجموعة الأولى من الجدول الدوري .
تشمل القلويات كل من
الليثيوم والصوديوم والبوتاسيوم والروبيديوم والسيزيوم والفرانسيوم
، ولا تشمل القلويات عنصر الهيدروجين الموجود على رأس المجموعة الأولى
لاختلافه في الصفات الكيميائية والفيزيائية عنها . |
رجوع
Back
|
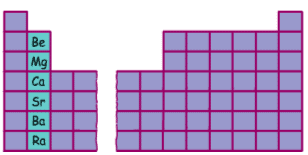 |
قلويات ترابية
Alkaline earth
metals
عنصر
فلز ينتمي الى المجموعة الثانية من الجدول الدوري .
تشمل القلويات كل من
البريليوم والمغنيسيوم والكالسيوم والسترونشيوم والباريوم والراديوم . |
رجوع
Back
قمع
Funnel
: أداة تستخدم في المختبرات لعمليات
الترشيح والإستخلاص .
رجوع
Back
قمع بخنر
Buchner Funnel
أداة تستخدم في المختبرات
لفصل مادة صلبة عن مادة سائلة باستخدام تفريغ الهواء
.
رجوع
Back
|
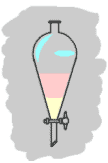 |
قمع فصل
Separation Funnel
أداة
تستخدم في المختبرات لفصل سائلين مختلفين عن بعضهما في الكثافة
.
وهو وعاء زجاجي عريض من الأعلى ورفيع من الأسفل ، في نهايته السفلية
صمام Stopcock ، ويستخدم لفصل سائلين مختلفين في الكثافة .
|
رجوع
Back
قنبلة هيدروجينية
Hydrogen bomb
رجوع
Back
|
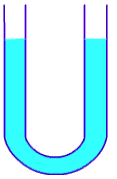 |
قنطرة ملحية
Salt bridge
أنبوب
على شكل حرف U يحتوي على محلول مادة أيونية ويصل بين نصفي الخلية
الغلفانية ، ويعمل على اعادة التوازن الكهربائي في نصفيها . |
رجوع
Back
قوة حيوية
Vital force :
قوة
كان يفترض أنها
وراء اصطناع جميع المركبات العضوية
.
رجوع
Back
قوى التجاذب بين الجزيئات
Intermolecular attractive forces
قوى ضعيفة نسبياً تعمل على جذب الجزيئات في حالتي المادة السائلة والصلبة
.
رجوع
Back
قوى ثنائي القطب
Dipole-dipole forces
قوى
تجاذب بين الجزيئات القطبية نتيجة لتجاذب الأقطاب متعاكسة الشحنة .تنشأ
قوى ثنائية القطب بين الجزيئات القطبية .
رجوع
Back
قوى لندن
London
forces :
قوى تجاذب ضعيفة نسبياً تعمل بين جميع أنواع الجزيئات نتيجة لتكون ثنائي قطب
لحظي عليها .
تتكون
قوى لندن بين جميع أنواع الجزيئات سواء أكانت قطبية أو غير قطبية
،
ولكنها تكتسب أهمية خاصة في الحالات الآتية :
1-الجزيئات غير القطبية .
2-الغازات النبيلة لأنها قوى التجاذب الوحيدة العاملة بين ذراتها .
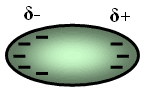 |
لنأخذ
مثلاً ذرة الأرغون, حيث أن يكون توزيع الشحنات السالبة حول النواة
الموجبة منتظماً إلا أنه للحظة قصيرة من الزمن تتجمع الشحنات السالبة في
أحد طرفي الذرة فتحمل حينئذ شحنة جزئية سالبة ويحمل الطرف الآخر شحنة
جزئية موجبة . |
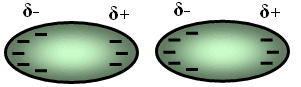 |
ويسمى هذا
التوزيع غير المنتظم للشحنات ثنائي القطب اللحظي ، ويؤثر ثنائي القطب
اللحظي في الذرات المجاورة ويجعلها مستقطبة بالحث ، فينشأ عن ذلك قوى
تجاذب فيما بينها من نوع لندن
.
تعتبر قوى لندن ضعيفة لأنها تنشأ عن استقطاب لحظي يظهر للحظة قصيرة من
الزمن ويختفي بعدها . |
رجوع
Back
قياسات يودية
Iodometry
استعمال الأيون
I-
والجزيء
I2
كعامل مختزل ومؤكسد على التوالي في عمليات التحليل الكمي .
رجوع
Back
|

