|
معادلة أرهينيوس
Arrhenius Equation
:
هي معادلة وضعها العالم الكيميائي السويدي ( المشهور بتعريفه للحمض
والقاعدة ) أرينيوس وهي تربط بين طاقة التنشيط
(Ea)
ودرجة الحرارة المطلقة (ط) وثابت سرعة التفاعل
(k)
وسنأخذها مسلماً بها وهي بالرموز كما يلي :
|
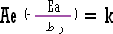 |
والرموز الأخرى هي :
A
ثابت خاص لكل تفاعل يعرف باسم ثابت أرينيوس
.
|
e |
= 2.7182818285 هي أساس
اللوغاريتم الطبيعي أو النيبري . |
ر :
ثابت الغازات العام الذي نستخدمه في المعادلة العامة
للغازات وقيمته 8.314 جول / مول . ط . |
فإذا أخذنا اللوغاريتم الطبيعي لطرفي المعادلة نحصل على
:
وبتحويل اللوغاريتم الطبيعي إلى لوغاريتم عشري حيث اللوغاريتم الطبيعي
= 2.3 لوغاريتم عشري .
|
أو |
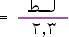 |
لـــو
............... |
فبقسمة طرفي المعادلة على 2.3 تصبح المعادلة السابقة :
|
 |
|
 |
...................... (1) |
|
لاحظ أن قيمة الثابت |
k |
للتفاعل ذاته تختلف باختلاف درجة
الحرارة ولذلك يمكن إيجاد قيمة طاقة التنشيط للتفاعل
بالتعويض في معادلة |
أرينيوس عند درجتي حرارة مختلفتين ، ولتوضيح ذلك
لنكتب معادلة أرينيوس عند درجتي حرارة مختلفتين ، ولتوضيح ذلك لنكتب
معادلة
|
أرينيوس للتفاعل ذاته عند الدرجة
ط1
: |
 |
.............................. (1) |
|
وعند
الدرجة ط 2
: |
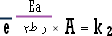 |
.............................. (2) |
|
وبقسمة
المعادلتين الواحدة على الأخرى : |
 |
1 |
2 |
3
|

