|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
أ) يتغير عدد تأكسد الأكسجين في H2O2 من ( -1 ) إلى ( -2 ) في جزيء H2O فالعملية اختزال. يتغير عدد تأكسد الأكسجين في H2O2 من ( -1 ) إلى ( صفر ) في جزيء O2 فالعملية تأكسد. وبما أن الأكسجين قد تأكسد واختُزل في نفس التفاعل فهو عامل مؤكسد ومختزل في نفس الوقت ، ويسمى التفاعل حينئذ تفاعل تأكسد واختزال ذاتي .
ب) التفاعلين قابلين للحدوث في الظروف المعيارية . من المعادلة الأولى يبدو أن المغنيسيوم أكثر ميلاً للتأكسد من النحاس . من المعادلة الثانية يبدو أن المغنيسيوم أكثر ميلاً للتأكسد من الألومنيوم . وبما أن جهد خلية ( Cu - Mg ) أعلى من جهد خلية ( Al - Mg ) لذا تكون أيونات النحاس أكثر ميلاً للاختزال من أيونات الألومنيوم ، وعليه عند وضع محلول كبريتات النحاس في وعاء من الألومنيوم فإن تفاعلاً بينهما سيحدث وعليه لا يمكن حفظ المحلول .
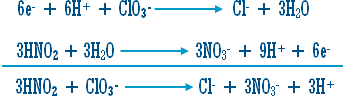
ج)
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Copyright © 2001 - 2010 SchoolArabia. All rights reserved الحقوق القانونية وحقوق الملكية الفكرية محفوظة للمدرسة العربية |
|||||||||||||||||||||||||||||||||||||||||||||||||