 |
|
الكهروسلبية
وقطبية الرابطة |
 إجابة
تدريب
:
إجابة
تدريب
:
1-
|
المركب
|
العنصر عالي
الكهروسلبية ( القطب السالب )
|
العنصر منخفض
الكهروسلبية ( القطب الموجب )
|
|
HCl
|
الكلور Cl
|
الهيدروجين
H
|
|
HI
|
اليود
I |
الهيدروجين
H
|
|
PBr3
|
البروم
Br |
الفسفور
P |
|
Cl2O
|
الأوكسجين
O |
الكلور Cl
|
|
NO
|
الأوكسجين
O |
النيتروجين
N
|
|
NH3
|
النيتروجين
N |
الهيدروجين
H
|
2-
أ-
H2
:
الذرتان متشابهتان ، إذن إلكتروني الربط يكونان على المسافة
نفسها من النواتين وبالتالي لايشكل قطبين أحدهما موجب والآخر سالب .
ب-
N2 :
الذرتان متشابهتان ، إذن إلكتروني الربط يكونان على المسافة
نفسها من النواتين وبالتالي لايشكل قطبين أحدهما موجب والآخر سالب .
|
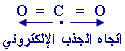
ج- CO2 :
الأوكسجين أكثر
كهروسلبية من الكربون ولكن الجزيء خطي وهذا هو شكله |
 |
قوة
الجذب الإلكتروني متساوية في المقدار متعاكسة في الاتجاه والمحصلة صفر
.
د- CH4
:
الشكل
رباعي الأوجه وعلى الرغم من أن كهروسلبية الكربون أعلى من كهروسلبية
الهيدروجين إلا أن
محصلة قوى الجذب
تساوي
صفر
.
هـ- He :
الجزيء يتكون من ذرة واحدة ولايوجد رابطة مشتركة
إذن لاتوجد قطبية .
3-
الفلور F
وكهروسلبيته ( 4 ) . موقعه في أعلى يمين الجدول الدوري .
4-
السيزيوم Cs
والفرانسيوم Fr
في الجزء
الأيمن الأسفل من الجدول الدوري .
5- تزداد الكهروسلبية من اليسار الصوديوم
( 0.9 ) إلى اليمين الكلور ( 3.0 ) . كل عنصر منها تزيد كهروسلبيته عن
العنصر المجاور له وإلى اليسار .
عناصر
المجموعة
الممثلة A في الدورة الرابعة
تزداد كهروسلبيتها من اليسار إلى اليمين تماماً كما في الدورة الثالثة
، أما عناصر المجموعات
B فقيمها متقاربة
ولاتنطبق عليها قاعدة ما .
ينطبق الكلام السابق على الدورة الخامسة أيضاً .
العلاقة
هي : تزداد كهروسلبية العنصر كلما اجهنا في
نفس الدورة من اليسار ( الفلزات ) إلى اليمين ( أي تزداد الخواص
اللافلزية ) .
6-
أ- I A
:
تنخفض الكهروسلبية كلما اتجهنا في المجموعة من
أعلى إلى أسفل ( أي كلما ازداد العدد الذري )
ب- IIA
:
تنخفض الكهروسلبية كلما اتجهنا في المجموعة من أعلى إلى أسفل ( أي كلما
ازداد العدد الذري ) .
ج-
VIA
:
تنخفض الكهروسلبية كلما اتجهنا في المجموعة من أعلى إلى أسفل ( أي كلما
ازداد العدد الذري ) .
العلاقة
: تزداد الكهروسلبية بين عناصر المجموعة
كلما كان العدد الذري أصغر وبالعكس تنقص الكهروسلبية كلما زاد العدد
الذري للعنصر .
رجوع

